(2009?广州)将下列两组中的两种反应物混合,回答下列问题:
(1)根据实验事实完成下表(没有发生反应的,化学方程式一栏“/”)
(2)分析上述实验,反应能够发生的共同原因是:反应物1中都含有(填化学用语,下同)
,反应物2中都含有.
(1)根据实验事实完成下表(没有发生反应的,化学方程式一栏“/”)
| 编号 | 反应物1 | 反应物2 | 现象 | 化学方程式 |
| 1 | 稀盐酸 | 氢氧化铜 | ||
| 2 | 稀硫酸 | 氢氧化钡溶液 | 有白色沉淀生成 | |
| 3 | 稀硝酸 | 澄清石灰水 | 没有明显现象 |
,反应物2中都含有.
现有稀盐酸、稀硫酸、氢氧化钡、碳酸钠4瓶失去标签的溶液,分别编号为A、B、C、D.每次取少量溶液两两混合,所观察到的现象记录在下表中(“-”表示无明显现象;“↓”表示有沉淀生成;“↑”表示有气体生成).
由此推断4瓶溶液中的溶质的化学式分别为:
A.;B.;C.;D.
写出上述实验过程的有关反应方程式:A+B、C+D.
| A | B | C | D | |
| A | - | ↑ | ↓ | - |
| B | ↑ | - | ↓ | ↑ |
| C | ↓ | ↓ | - | - |
| D | - | ↑ | - | - |
A.;B.;C.;D.
写出上述实验过程的有关反应方程式:A+B、C+D.
碳酸钠用途非常广泛,是工业生产中重要的化工原料.在1921年我国科学家侯德榜创造了一种著名的纯碱生产方法--“联合制碱法”.
“联合制碱法”生产过程:
(1)第一步主要反应为NH3+CO2+H2O=NH4HCO3该反应属于反应基本反应类型.
(2)第二步用食盐与NH4HCO3反应.食盐来源于某盐田,该粗盐主要含有氯化钠,此外还含有少量硫酸钠,氯化钙和氯化镁.经净化、精制得到生产碳酸钠所需要的食盐水,其主要流程如下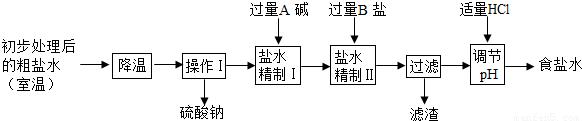
①通过降温使硫酸钠从粗盐水中析出,其原理是氯化钠和硫酸钠的溶解度与温度的变化差异较大,请在溶解度图(如图)中简单画出氯化钠和硫酸钠的溶解度曲线变化趋势图.
②“精制I”操作中,加入过量含钙元素的碱的化学式是.其反应化学方程示为.
③“精制II”操作中,加入B盐的有关反应方程式为.
④为保证“精制II”操作中过量B盐把杂质全部除去,请在下表中写出检验溶液中B盐是否过量的实验报告.
⑤查阅资料得知NaCl、NH4HCO3、NaHCO3、NH4Cl在30℃时的溶解度如下表所示:
请根据溶解度表所提供的信息,写出“联合制碱法”中的第二步属于复分解反应的化学方程式:.
(3)第三步处理制得碳酸钠,反应原理为2NaHCO3 Na2CO3+H2O+CO2↑
Na2CO3+H2O+CO2↑
0 93498 93506 93512 93516 93522 93524 93528 93534 93536 93542 93548 93552 93554 93558 93564 93566 93572 93576 93578 93582 93584 93588 93590 93592 93593 93594 93596 93597 93598 93600 93602 93606 93608 93612 93614 93618 93624 93626 93632 93636 93638 93642 93648 93654 93656 93662 93666 93668 93674 93678 93684 93692 211419
“联合制碱法”生产过程:
(1)第一步主要反应为NH3+CO2+H2O=NH4HCO3该反应属于反应基本反应类型.
(2)第二步用食盐与NH4HCO3反应.食盐来源于某盐田,该粗盐主要含有氯化钠,此外还含有少量硫酸钠,氯化钙和氯化镁.经净化、精制得到生产碳酸钠所需要的食盐水,其主要流程如下

①通过降温使硫酸钠从粗盐水中析出,其原理是氯化钠和硫酸钠的溶解度与温度的变化差异较大,请在溶解度图(如图)中简单画出氯化钠和硫酸钠的溶解度曲线变化趋势图.

②“精制I”操作中,加入过量含钙元素的碱的化学式是.其反应化学方程示为.
③“精制II”操作中,加入B盐的有关反应方程式为.
④为保证“精制II”操作中过量B盐把杂质全部除去,请在下表中写出检验溶液中B盐是否过量的实验报告.
| 实验操作 | 实验现象 | 实验结论 |
| |
| 温度 | NH4Cl | NH4HCO3 | NaHCO3 | NaCl |
| 30℃ | 41.1g | 27.0g | 11.1g | 36.3g |
(3)第三步处理制得碳酸钠,反应原理为2NaHCO3
 Na2CO3+H2O+CO2↑
Na2CO3+H2O+CO2↑ 

