下列图示的实验操作中,不正确的是( )
A、 熄灭酒精灯 | B、 称取氯化钠固体 | C、 读取液体体积 | D、 溶解氯化钠 |
下列实验操作错误的是( )
A、 称量固体药品 | B、 取氯化钠 | C、 溶解 | D、 蒸发 |
配制一定溶质质量分数的氯化钠溶液,如图所示实验操作不正确的是( )
A、 氯化钠的取用 | B、 氯化钠的称量 | C、 水的量取 | D、 氯化钠的溶解 |
 锌与硫酸反应的快慢受多种因素的影响.用不同质量分数的硫酸和不同形状的锌进行了相应影响因素的探究,实验数据如表.
锌与硫酸反应的快慢受多种因素的影响.用不同质量分数的硫酸和不同形状的锌进行了相应影响因素的探究,实验数据如表.| 实验编号 | 硫酸的质量分数(均取20mL) | 锌的形状(均取1g) | 氢气的体积(mL)(均收集3分钟) |
| ① | 15% | 锌粒 | 31.7 |
| ② | 20% | 锌片 | 50.9 |
| ③ | 20% | 锌粒 | 61.7 |
| ④ | 30% | 锌片 | 79.9 |
(2)要比较不同质量分数的硫酸对反应快慢的影响,应选择的实验编号是
(3)通过四组实验比较,你的结论是
(4)如表是第①组实验的详细数据.请继续分析.
| 时段(均为1分钟) | 第1分钟 | 第2分钟 | 第3分钟 | 第4分钟 | 第5分钟 | 第6分钟 |
| H2的体积 | 3.1mL | 16.7mL | 11.9mL | 9.6mL | 7.6mL | 6.0mL |
(5)锌与硫酸反应的快慢还与
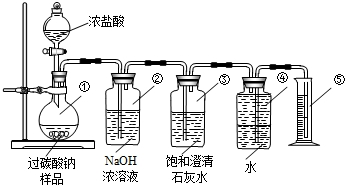
 为测定碳酸氢钠纯度(含有少量氯化钠),某学生拟用如图实验装置,以下实验设计正确的是( )
为测定碳酸氢钠纯度(含有少量氯化钠),某学生拟用如图实验装置,以下实验设计正确的是( )| A、可用稀盐酸代替稀硫酸 | B、量气管中液体为水 | C、反应完全后,冷却,读取量气管体积数,再减去所加硫酸的体积,即为生成的气体体积 | D、实验测得该试样中碳酸氢钠质量分数偏高,可能是测定气体体积时未冷却至室温 |
工业上常用侯德榜先生发明的联合制碱法生产碳酸钠(纯碱)和氯化铵,但却不能用此法制取碳酸钾,这是因为在溶液中( )
| A、K2CO3 溶解度较小 | B、K2CO3 溶解度较大 | C、KHCO3 溶解度较小 | D、KHCO3 溶解度较大 |
我国制碱工业先驱--侯德榜先生发明的侯氏制碱法的主要原理是:NH3+CO2+H2O+NaCl═NaHCO3↓+NH4Cl.关于这一反应的说法正确的是( )
| A、该反应属于化合反应 | B、该反应属于复分解反应 | C、反应的各元素存在化合价变化 | D、该反应能进行是因为NaHCO3溶解度较小 |

 甲、乙两个实验小组分别进行“测定Na2CO3和NaCl混合物中Na2CO3含量”的实验.
甲、乙两个实验小组分别进行“测定Na2CO3和NaCl混合物中Na2CO3含量”的实验.