某兴趣小组在实验室中模拟炼铁化学原理的实验,对固体产物成分等进行探究。
 |
【设计实验】用一氧化碳还原纯净的氧化铁粉末,实验装置如下图。
【进行实验】该小组按上述实验设计,在一定温度下进行了实验,测得下列数据:
①反应前玻璃管和内盛氧化铁粉末的总质量66.0g(玻璃管的质量为60.0g)
②反应后玻璃管和内盛黑色固体的总质量65.8g(冷却到室温称量)
【分析与讨论】本实验中,玻璃管内固体粉末由红色全部变为黑色。小明同学认为该黑色固体全部是铁,但小华同学提出了质疑,于是大家提出查阅资料。
【查阅资料】①CO还原Fe2O3的固体产物的成分与反应温度、反应时间等因素有关;
②CO还原Fe2O3的实验过程中固体产物可能有Fe3O4、FeO、Fe;
③NaOH溶液与石灰水相似,能吸收CO2,但不变浑。
| 物质性质 | 四氧化三铁 | 氧化亚铁 | 氧化铁 | 铁粉 |
| 颜色 | 黑色 | 黑色 | 红色 | 黑色 |
| 能否被磁铁吸引 | 能 | 不能 | 不能 | 能 |
④
【实验与猜想】
(1)该小组同学将反应后的黑色固体研磨后,再用磁铁吸引,发现黑色固体粉末全部能被吸引,则该黑色固体粉末中不可能含有氧化铁和 ▲ 。
(2)进行猜想:黑色固体粉末可能a.全部为铁、 b. ▲ 、c. ▲ 。
【得出结论】
(3)通过实验中获得的数据进行计算,得出黑色固体粉末为(写名称) ▲ 。
【反思与评价】
(4)一氧化碳还原氧化铁的实验中,若要得到铁可适当提高反应温度。
(5)实验装置图中采用虚线框内的装置,其作用有 ▲ 。
A.收集CO B.吸收CO2 C.检验CO2
【实践应用】小明和他的同学 想测定某赤铁矿石中Fe2O3的质量分数。用CO与10g赤铁矿石样品充分反应(杂质不参与反应),并将生成的气体用足量的NaOH溶液完全吸收,该溶液总质量与反应时间的变化关系如右图。
想测定某赤铁矿石中Fe2O3的质量分数。用CO与10g赤铁矿石样品充分反应(杂质不参与反应),并将生成的气体用足量的NaOH溶液完全吸收,该溶液总质量与反应时间的变化关系如右图。
(6)上述反应产生CO2的质量为 ▲ g;
(7)计算该赤铁矿石中氧化铁的质量分数。 ▲ 。(需要有计算过程)
小兵对“锌与硫酸反应快慢的影响因素”进行了探究。
【提出问题】锌与硫酸反应的快慢受哪些因素的影响呢?
【猜想与假设】a.可能与硫酸的质量分数有关; b.可能与锌的形状有关。
 【设计并实验】小兵用不同质量分数的硫酸和不同形状的锌进行如下实验。
【设计并实验】小兵用不同质量分数的硫酸和不同形状的锌进行如下实验。
| 实验编号 | 硫酸的质量分数(均取20mL) | 锌的形状(均取1g) | 氢气的体积(mL)(均收集3分钟) |
| ① | 20% | 锌粒 | 31.7 |
| ② | 20% | 锌片 | 50.9 |
| ③ | 30% | 锌粒 | 61.7 |
| ④ | 30% | 锌片 | 79.9 |
(1)写出稀硫酸与锌反应的化学方程式 ▲ 。
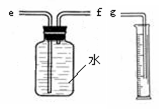
(2)小兵用右图装置收集并测量氢气的体积,其中量筒的作用是 ▲ ,氢气应从 ▲ (填e或f)管通入。
【收集证据】(3)要比较不同质量分数的硫酸对反应快慢的影响,应选择的实验编号是 ▲ 。
【得出结论】(4)结论是 ▲ 。


 2X+2TiCl4+6CO,则X为 ▲ ;
2X+2TiCl4+6CO,则X为 ▲ ; (4)那么竹子里的气体含量与空气有什么区别呢?于是,他又用空气重做了上述两个实验.相比较后得出的结论是 ▲ 。
(4)那么竹子里的气体含量与空气有什么区别呢?于是,他又用空气重做了上述两个实验.相比较后得出的结论是 ▲ 。