已知某混合金属粉末中除铝外还含有铁、铜中的一种或两种,所含金属的量都在5%以上。请设计实验探究该粉末中铁、铜的存在。
资料在线:铝与氢氧化钠溶液反应生成溶于水的偏铝酸钠和氢气(2Al+2H2O+2NaOH=
2NaAlO2+3H2↑),铁和铜不与氢氧化钠溶液反应。
可供选择的实验用品:烧杯、大试管 、量筒、滴管、燃烧匙、药匙、磁铁;
、量筒、滴管、燃烧匙、药匙、磁铁;
稀硫酸、稀盐酸、Na0H溶液、氨水。
请你参与并完成以下实验探究过程:
I、提出假设
(1)假设1:该混合金属粉末中除铝外还含有Fe。
(2)假设2:该混合金属粉末中除铝外还含有 ▲ 。
(3)假设3:该混合金属粉末中除铝外还含有Fe、Cu。
II、设计并实施实验方案
(4)基于假设1,不用化学试剂,证明金属铁的存在可用 ▲ 。
(5)基于假设2,将混合金属粉末加入足量稀盐酸,你观察到的现象是 ▲ 。
(6)基于假设3,请你完成实验操作,描述实验现象。
| 实验步骤 |
| 实验现象 | 结论 |
| ① | 取少许粉末放入大试管中,再滴加 ▲ ,充分反应后,静置,弃去清液得到固体。 | 固体粉末 ▲ , 有 ▲ 。 | 仅除去铝 |
| ② | 再往大试管中加 ▲ ,充分反应。 | 固体 ▲ , 溶液 ▲ 。 | 证明含有铁 |
| ③ | 将大试管静置,弃去上层清液,加水,多次洗涤剩余固体 | 剩余固 | 证明含有铜 |
III、已知该金属粉末的组成为铝、铁和铜
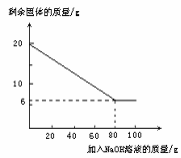
(7)为测定混合金属粉末中铝的质量分数,取20 g该金属粉末,把100 g氢氧化钠溶液平均分成5份依次加入,充分反应后,过滤出固体,将其洗涤、干燥、称量。实验过程中得到的部分数据与图象如下:
| 加NaOH溶液的次数 | 第一次 | 第二次 | 第三次 | … |
| 剩余固体的质量/g | 1 6.5 | n | 9.5 | … |
①分析以上数据可知,上表中n的值为 ▲ ;
②该金属粉末中Al的质量分数为 ▲ %;
③列式计算:所用氢氧化钠溶液的溶质质量分数为多少?
某厂废水中含有质量分数为4.9%的H2SO4,需中和后才能排放。某兴趣小组同学经过讨论,提出了两种中和方案,所用试剂的价格如下:
| 中和试剂 | 氢氧化钠 | 氢氧化钙 |
| 价格/(元·吨-1) | 800 | 450 |
(1)请从经济与产物角度说明选择氢氧化钙的理由: ① ▲ ;② ▲ 。
(2)有同学建议用氨水进行中和,可以回收一种化肥。但该废水会引起的环境问题是
▲ (选填编号)。
A.重金属污染 B.有毒物质污染 C.富营养化污染 D.悬浮物污染
 实验操作(说明仪器和试剂)
实验操作(说明仪器和试剂)
 ,该固体物质在实际生活中的一种用途是 ▲ 。
,该固体物质在实际生活中的一种用途是 ▲ 。
 (2)操作Ⅰ和操作Ⅱ的过滤操作中,需要将
(2)操作Ⅰ和操作Ⅱ的过滤操作中,需要将
 此外,也可用加热碳酸氢钠(NaHCO3)固体(产物为碳酸钠、二氧化碳、水)来制取CO2,该反应的化学方程式 ▲ ,若用此法来制取CO2,应选用的发生装置为 ▲ ,收集装置为 ▲ 。
此外,也可用加热碳酸氢钠(NaHCO3)固体(产物为碳酸钠、二氧化碳、水)来制取CO2,该反应的化学方程式 ▲ ,若用此法来制取CO2,应选用的发生装置为 ▲ ,收集装置为 ▲ 。
 壤的碱是 ▲ ;(4)胃液中的酸 ▲ ;
壤的碱是 ▲ ;(4)胃液中的酸 ▲ ;