现有下列装置,回答问题:
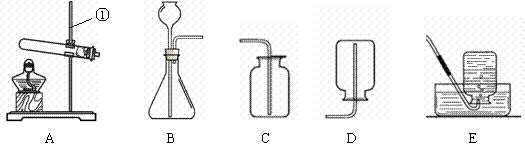 |
(1)写出有标号仪器的名称:① ▲ ;
(2)检查B装置的气密性的方法是: ▲ ,向长颈漏斗中加适量的水,若观察到长颈漏斗末端出现稳定的水柱,则装置不漏气;
(3)实验室制取H2的反应化学方程式为 ▲ ,发生装置为 ▲ ;
(4)实验发现:用40%的硫酸制取H2效果最好。现欲配制30mL 40%(密度为1.30g·mL—1)的硫酸,需要98%(密度为1.84g·mL—1)的浓硫酸 ▲ mL(精确到小数点后一位),需要水 ▲ mL(精确到小数点后一位)。量取浓硫酸时,若仰视读数(其他操作均正确),则所配硫酸的质量分数 ▲ 40%(填“>”或“=”或“<”),配制过程不需要的仪器是 ▲ ;
A.托盘天平 B.量筒 C.烧杯 D.玻璃棒 E.胶头滴管 F.铁架台
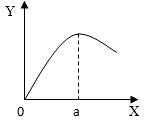
(5)实验室制取H2时,在硫酸溶液中滴入饱和CuSO4溶液会影响反应速率。右图是滴入饱和CuSO4溶液体积(X)与反应速率(Y)的关系图,请回答:
①滴入CuSO4溶液后,发生反应的化学方程式为 ▲ ;
②a点过后,反应速率降低的原因可能是 ▲ 。
关注碳排放。
(1)化石燃料属于 ▲ (填“可再生”或“不可再生”)能源,请你推荐一种新型绿色的能源 ▲ ;
(2)下列做法不符合“低碳”生活理念的是 ▲ ;
A.使用一次性木筷和纸巾 B.推广电热水器 C.逐步淘汰白炽灯
 (3)CO2过多排放是城市“热岛效应”的原因之一。右图中地点Ⅰ、Ⅱ分别为
(3)CO2过多排放是城市“热岛效应”的原因之一。右图中地点Ⅰ、Ⅱ分别为
▲ ;
A.农田、商业区
B.公园、居民区
C.市中心、公园
(4)下表是CO2排放系数及一个家庭的月消耗(产生)数量:
| 项目 | 电 | 液化石油气 | 自来水 | 垃圾 | …… |
| 系数 | 0.36 kg/kwh | 6.3 kg/m3 | 0.58 kg/m3 | 0.84 kg/ kg | …… |
| 数量(/月) | 100 kwh | 7 m3 | 5 m3 | 15 kg | …… |
则一个家庭每月至少排放 ▲ kg CO2;
(5)研究发现:CO2和H2在催化剂、加热条件下反应生成甲醇(CH4O)和水,反应的化学方程式为 ▲ 。金属铈(Ce)和CO2、H2O在900℃条件下反应,生成两种可燃性气体和CeO2,反应的化学方程式为 ▲ 。利用CO2和环氧乙烷制成的塑料无污染、易降解,可减少 ▲ 的发生。
材料在生活中应用很广泛。
(1)下列生活物品属于无机材料的是 ▲ ;
 |
A.玻璃杯 B.铁锅 C.塑料桶 D.玻璃钢转椅
(2)现行流通的硬币材质均为金属材料,如一元硬币是钢芯镀镍(Ni),伍角硬币是钢芯镀铜,一角硬币是铝合金或不锈钢。
①选择铸造硬币的材料不需要考虑的因素是 ▲ (填序号);
A.金属的导电性 B.金属的耐腐蚀性
C.金属的硬度 D.金属价格与硬币面值的吻合度
②五角硬币镀铜是因为常温下,铜的化学性质 ▲ (填“稳定”或“活泼”);
③钢是一种含碳量为 ▲ (填数值)的铁合金,其硬度比铁 ▲ (填“大”或“小”);
 ④在一定条件下,镍在空气中会形成致密的氧化膜(NiO),反应的化学方程式为 ▲ 。镍和稀硫酸反应会生成硫酸镍(NiSO4)和一种可燃性气体单质,反应化学方程式为 ▲ ;
④在一定条件下,镍在空气中会形成致密的氧化膜(NiO),反应的化学方程式为 ▲ 。镍和稀硫酸反应会生成硫酸镍(NiSO4)和一种可燃性气体单质,反应化学方程式为 ▲ ;
⑤根据右图镍原子的结构示意图回答:镍原子的原子序数是 ▲ ,在化学变化中易 ▲ 电子(填“得到”或“失去”)。
某钢铁厂用800吨(Fe%=75%)FeO、Fe2O3、Fe3O4的混合铁矿石炼铁,炼得生铁(非铁元素含量<8%)的质量可能是(生铁中C%为2% ~ 4.3%)
| A.600吨 | B.608吨 | C.625吨 | D.676.5吨 |
下列物质的除杂实验中,所选用的试剂、方法及反应类型均正确的是
| 选项 | 物质(括号内为杂质) | 试剂、方法 | 反应类型 |
| A. | CaO(CaCO3) | 高温 | 分解反应 |
| B. | Fe(Fe2O3) | 足量CO | 置换反应 |
| C. | CO2(CO) | 足量O2 | 化合反应 |
| D. | CaCl2溶液(HCl) | 足量CaCO3 | 复分解反应 |
右图是甲、乙两种固体的溶解度曲线,下列说法正确的是
| A.甲的溶解度大于乙的溶解度 |
| B.10℃时,等质量的甲乙饱和溶液中溶质质量相等 |
| C.20℃时,将10g甲物质加入50g水中,得到60g溶液 |
| D.30℃时,甲物质饱和溶液中,溶质质量分数最大为60% |

下列有关化学基本概念的说法中,错误的是
| A.同种元素可以组成不同的单质 | B.发光发热现象都由物质燃烧引起 |
| C.含氧元素的化合物不一定是氧化物 | D.含碳化合物不一定是有机化合物 |
 C.反应后的生成物都是氧化物
C.反应后的生成物都是氧化物