某兴趣小组对食用纯碱和食用小苏打两种粉末进行以下探究。
[查阅资料]
| 名称 | 食用纯碱 | 食用小苏打 |
| 主要成分 | Na2CO3 | NaHCO3 |
| 酸碱性 | 水溶液显碱性 | 水溶液显碱性 |
| 热稳定性 | 受热不分解 | 270℃时完全分解为碳酸钠、二氧化碳、水 |
[实验探究]
(1)探究两者水溶液酸碱性的差异
 小明分别向等浓度的两种溶液中滴入酚酞试液,发现两者都变 ▲ 色,但食用纯碱溶液中颜色更深,由此推测可能 ▲ 溶液碱性更强。小欢认为要比较两种溶液的碱性强弱,可直接用 ▲ 进行测定。
小明分别向等浓度的两种溶液中滴入酚酞试液,发现两者都变 ▲ 色,但食用纯碱溶液中颜色更深,由此推测可能 ▲ 溶液碱性更强。小欢认为要比较两种溶液的碱性强弱,可直接用 ▲ 进行测定。
(2)验证两种粉末的稳定性
在老师的指导下,该小组按右图装置进行实验操作,观察到 ▲ (填“甲”或“乙”)烧杯中澄清石灰水变浑浊,试管中发生反应的化学方程式为 ▲ ,装置中棉花的作用是 ▲ 。
(3)测定食用纯碱粉末的纯度
取食用纯碱粉末试样,利用右图装置进行实验测定。
 数据记录如下:
数据记录如下:
| 称量项目 | 称量时间 | 质量/g |
| 试样 | 11.0 | |
| 装置+稀盐酸 | 160.0 | |
| 装置+稀盐酸+试样 | 反应开始后20s | 167.0 |
| 装置+稀盐酸+试样 | 反应开始后30s | 166.6 |
| 装置+稀盐酸+试样 | 反应开始后90s | 166.6 |
(5)反应生成CO2的质量为 ▲ g。
(6)通过计算确定食用纯碱粉末中Na2CO3的质量分数。(写出计算过程,结果保留一位小数。)
③ 如果测得的结果比实际纯度高,可能的原因是 ▲ 。(答一种即可)
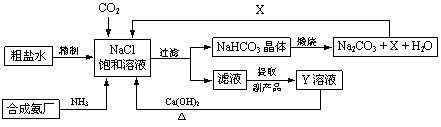
我国制碱工业的先驱侯德榜将制碱与制氨结合起来的联合制碱法,为纯碱和氮肥工业技术的发展做出了杰出的贡献。其生产工艺流程示意图如下:
 |
| 部分物质溶解性(室温) | |||
| OH- | SO42- | CO32- | |
| Mg2+ | 不 | 溶 | 微 |
| Ca2+ | 微 | 微 | 不 |
| Ba2+ | 溶 | 不 | 不 |
⑴粗盐水中主要含有Ca2+、Mg2+、SO42-等杂质离子,工业上常用加入稍过量的NaOH溶液、Na2CO3溶液、BaCl2溶液及适量的盐酸等除杂、精制。则加入试剂合理的顺序为 、盐酸(只写一种)。加盐酸的作用是(用化学方程式表示) 、 。
⑵制碱原理为:NaCl + CO2 + NH3 + H2O = NaHCO3↓+ NH4Cl,该反应原理可看作是由①CO2 + NH3 + H2O = NH4HCO3和②NaCl + NH4HCO3 = NaHCO3↓+ NH4Cl两个反应加合而成,则的反应类型为 。
⑶X的化学式为 。
⑷Y是滤液中最主要成分,Y与Ca(OH)2反应的产物之一可用于循环使用,该产物的名称为 ,Y的化学式为 ,写出Y的一种用途 。






 (2)小红同学用下图总结了NaOH的四条化学性质(即NaOH与四类物质能够发生化学反应)。
(2)小红同学用下图总结了NaOH的四条化学性质(即NaOH与四类物质能够发生化学反应)。
