 以下是Na2CO3、NaHCO3的溶解度表及溶解度曲线.
以下是Na2CO3、NaHCO3的溶解度表及溶解度曲线.(1)Na2CO3溶解度曲线为
| 0℃ | 10℃ | 20℃ | 30℃ | 40℃ | |
| Na2CO3的溶解度(g/100g水) | 7.1 | 12.5 | 21.5 | 39.7 | 49.0 |
| NaHCO3的溶解度(g/100g水) | 6.9 | 8.1 | 9.6 | 11.1 | 12.7 |
Ⅰ.冷却结晶Ⅱ.蒸发结晶Ⅲ.溶解过滤
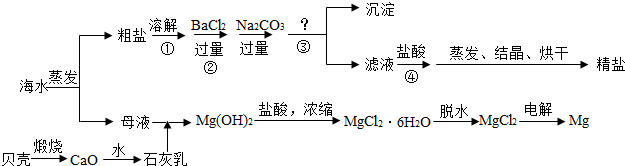
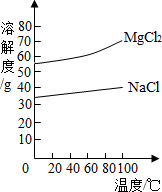
(3)已知Na2CO3转化为NaHCO3的反应为Na2CO3+CO2+H2O→2NaHCO3,根据以上信息,要除去NaHCO3饱和溶液中的少量Na2CO3,应采用的化学方法是
(4)40℃时的100.0g Na2CO3的饱和溶液中含有






 25、盐酸和氢氧化钠溶液(滴有酚酞试液)发生反应过程中溶液的pH变化如下图.下列有关该实验事实的说法错误的是( )
25、盐酸和氢氧化钠溶液(滴有酚酞试液)发生反应过程中溶液的pH变化如下图.下列有关该实验事实的说法错误的是( )