下列说法正确的是( )
| A、自然界中的水大多数是纯水,水是一种常见的溶剂 | B、20℃时,KNO3的溶解度为31.6g,则其饱和溶液中溶质的质量分数为31.6% | C、升高温度时,饱和溶液一定能变为不饱和溶液 | D、生活中常用煮沸的方法来降低水的硬度 |
对以下三个化学反应的分析正确的是( )
C+O2
CO2 ;4P+5O2
2P2O5;CH4+2O2
CO2+2H2O.
C+O2
| ||
| ||
| ||
| A、反应物均是单质 |
| B、生成物均是氧化物 |
| C、生成物均是气体 |
| D、反应时均产生蓝色火焰 |
 某课外活动小组欲对铝镁合金进行研究,测定其中镁的质量分数.
某课外活动小组欲对铝镁合金进行研究,测定其中镁的质量分数.【查阅资料】
(1)氢氧化镁和氢氧化铝据难溶于水.难溶碱受热后能分解生成水和相应的金属氧化物.
(2)镁和氢氧化镁均不能与氢氧化钠溶液反应,但铝和氢氧化铝均能能与氢氧化钠溶液发生如下反应:2Al+2NaOH+2H2O=2NaAlO2+3H2↑ Al(OH)3+NaOH=NaAlO2+2H2O
【方案设计】他们利用实验室提供的盐酸、氢氧化钠溶液设计了三种不同的实验方案:
方案一:铝镁合金
| ||
方案二:铝镁合金
| ||
方案三:铝镁合金
| ||
| ||
【方案评价】
1)三个方案是否均可行,如有不可行的请说明理由.
2)如果你是小组成员,你愿意采用何种方案?
【实验设计】实验小组根据方案二设计了如下图所示(图中的铁架台已省略)的两个实验装置.
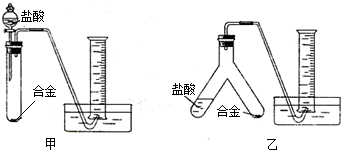
你认为选择
【交流讨论】
(1)小组成员实验后,通过交流讨论普遍认为上述三个实验方案均存在操作不够简便或容易产生测量误差的问题.于是按照上述形式重新设计了方案,请你帮助他们完成新方案的设计(在→上方填写相应的试剂和操作):
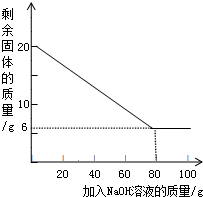
2)小组成员按照新的测定方案,取20g铝镁合金,研成金属粉末后,把100g氢氧化钠溶液平均分成5份依次加入,充分反应后,过滤出固体,将其洗涤、干燥、称量.实验过程中得到的部分数据与图象如下:
| 加NaOH溶液的次数 | 第一次 | 第二次 | 第三次 | … |
| 剩余固体的质量/g | 1 6.5 | n | 9.5 | … |
(2)分析以上数据可知,上表中n的值为
(3)该金属粉末中Al的质量分数为
(4)列式计算:所用氢氧化钠溶液的溶质质量分数为多少?计算过程:
 在实验探究课上,老师给了同学们一包红色粉未,该粉末是铜粉和氧化铁粉中的一种或两种.同学们为了确定该粉末的成分,进行如下探究.请你参与他们的探究并回答问题.
在实验探究课上,老师给了同学们一包红色粉未,该粉末是铜粉和氧化铁粉中的一种或两种.同学们为了确定该粉末的成分,进行如下探究.请你参与他们的探究并回答问题.(1)【提出问题】假设l:红色粉末是铜粉;假设2:红色粉末是氧化铁粉;
假设3:红色粉末是
(2)【设计实验方案】同学们对实验作了如下设想和分析:取少量红色粉末放入硬质玻璃管中,通入一氧化碳片刻后加热至充分反应(实验装置如图所示).
请你完成下表:
| 实验中可能出现的现象 | 结论 |
| 假设1成立 | |
| 假设2成立 | |
| 假设3成立 |
(4)【反思与评价】
①实验过程中,硬质玻璃管内发生反应的化学方程式是
②实验时通入一氧化碳片刻后再加热的原因是
③从环保角度看,上面的实验装置有不足之处,请你对该装置进行改进,具体措施
是
(5)【拓展】为了进一步探究铁和铜的金属活动性强弱,请根据实验室现有的仪器和药品条件(如下所列),通过填写下表,完成对实验方案的构思.
[实验仪器]试管、胶头滴管、镊子
[实验药品]铁钉、铜片、稀硫酸、硫酸锌溶液、硫酸亚铁溶液、硫酸铜溶液
| 所选药品 | 有关化学方程式 |

 右图表示某些物质间转化关系.其中A、E、G为固体,且A、G均为单质,E为红棕色固体,G为常见金属;C、F、D、H为无色气体,其中C、F是由相同元素组成的无色气体,且C有毒;B为常见的无色液体,I为有机物.请回
右图表示某些物质间转化关系.其中A、E、G为固体,且A、G均为单质,E为红棕色固体,G为常见金属;C、F、D、H为无色气体,其中C、F是由相同元素组成的无色气体,且C有毒;B为常见的无色液体,I为有机物.请回