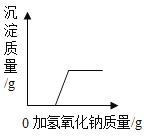
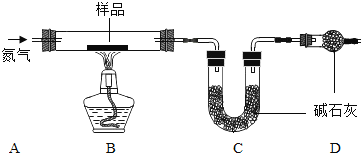
【题目】已知复分解反应![]() 可进行。在常温下,测得相同浓度的下列六种溶液的pH:表中数据揭示出复分解反应的一条规律,即碱性较强的物质发生类似反应可以生成碱性弱的物质。依照该规律,请你判断下列反应不能成立的是
可进行。在常温下,测得相同浓度的下列六种溶液的pH:表中数据揭示出复分解反应的一条规律,即碱性较强的物质发生类似反应可以生成碱性弱的物质。依照该规律,请你判断下列反应不能成立的是
溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN |
pH | 8.8 | 8.6 | 11.6 | 10.3 | 11.1 |
A.![]()
B.![]()
C.![]()
D.![]()
【题目】某化工厂为综合利用生产过程中的副产品CaSO4,与相邻的化肥厂联合设计了制备(NH4)2SO4的工艺流程.
(工艺流程及原理)
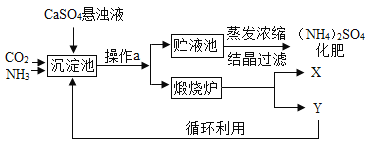
沉淀池中发生的主要化学反应为:CO2+2NH3+CaSO4+H2O=CaCO3↓+(NH4)2SO4
(讨论交流)
(1)操作a的名称是______,若在实验室进行此操作,用到的玻璃仪器除玻璃棒、烧杯外,还需要______。
(2)经操作a后得到的固体物质在煅烧炉中高温分解生成X和Y两种物质,该工艺中,Y被作为原料之一循环利用.Y的化学式为______。
(3)沉淀池中也可能生成少量NH4HCO3,该反应的化学方程式为______。
(硫酸铵化肥等级测定)
(1)判断(NH4)2SO4化肥中有无NH4HCO3:取少量试样溶于水,滴加足量的______,无气泡产生,则可判断该化肥中不存在NH4HCO3。
(2)化肥中氮元素含量的测定(已确定该化肥中不存在NH4HCO3杂质):
(查阅资料)
①已知:![]() ,氨气极易溶于水,其水溶液为氨水.氨水呈碱性,不稳定,易挥发.
,氨气极易溶于水,其水溶液为氨水.氨水呈碱性,不稳定,易挥发.
②工业判断硫酸铵化肥等级指标如下:
指标 项目 | 优等品 | 合格品 |
氮(N)含量 | ≥21.0% | ≥20.5% |
(实验设计)
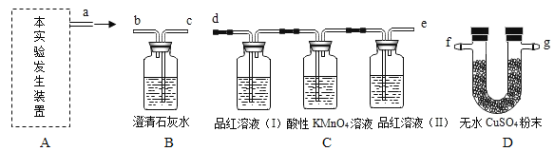
按图所示装置进行实验.
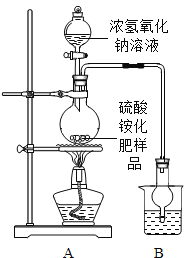
(1)实验过程中,往烧瓶中加入足量浓氢氧化钠溶液,并加热使硫酸铵充分反应完全转化为NH3.
(2)烧杯中的试剂是为了吸收产生的氨气,下列最适宜的试剂是______(填序号);
①水;②浓HCl;③稀H2SO4;④NaOH溶液
烧杯中干燥管的作用是______。
(交流讨论)
实验小组的同学认为,用上述实验装置测得的结果可能会出现下列情况.
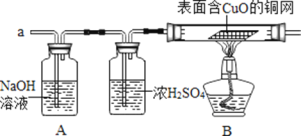
(1)甲同学认为:应在实验装置A、B之间增加一个装有______(填“浓硫酸“或“碱石灰”)的干燥装置,否则实验测得的硫酸铵化肥含氮量可能偏高.
(2)乙同学认为:在实验装置A、B之间增加正确的干燥装置后进行实验,测得的硫酸铵化肥含氮量可能偏低,理由是______。
(实验测定)
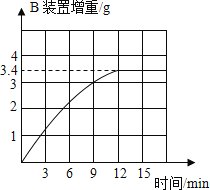
经讨论后,他们改进了实验装置,排除了可能产生误差的因素,重新进行实验。取硫酸铵化肥样品13.5 g进行实验,测得B装置增重与反应时间的关系如图所示.请通过计算判断该化肥的等级.计算过程:_____;该化肥的等级为______品。