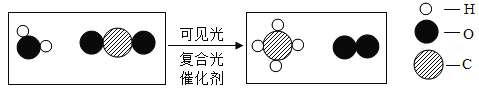
【题目】某研究小组对自动充气气球(如图所示)进行下列探究。
[查阅资料]该气球充气原理是通过挤破液体包,使液体与白色粉末接触产生二氧化碳气体,实现气球自动充气。

(1)为检验气体是二氧化碳,其方法是__________________。
探究一:液体包内溶液酸碱性的探究
(2)室温时,用pH试纸测得溶液的![]() ,则该溶液呈________性。
,则该溶液呈________性。
探究二:白色粉末成分的探究
[猜想与假设]小松同学认为是碳酸钙;小娟同学认为是碳酸钠;小华同学认为是碳酸氢钠。
[设计并进行实验]
(3)将少量白色粉末放入水中搅拌,固体全部溶解,说明______同学的猜想不正确。
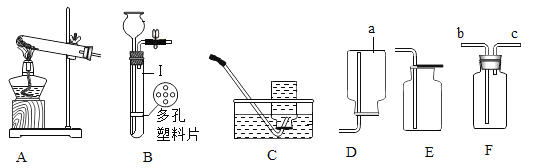
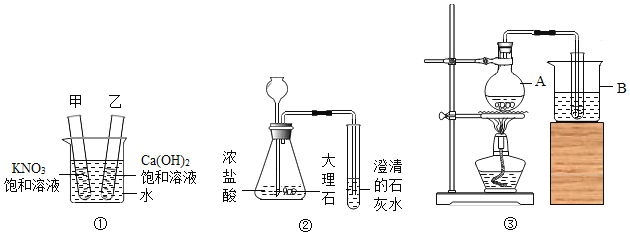
(4)室温时,分别向盛有碳酸氢钠、碳酸钠和白色粉末样品的锥形瓶中注入等体积、足量的10%盐酸(实验装置如图所示),实验记录如下表所示:
实验编号 | 锥形瓶物质 | 最终得到 | |
名称 | 质量/g | ||
① | 碳酸氢钠 | 0.10 | V1 |
② | 碳酸钠 | 0.10 | V2 |
③ | 白色粉末 | A | V3 |

[分析并得出结论]
当表中A=______,V=______(填“V1”,或“V2”),得出结论该白色粉末是碳酸氢钠。
【题目】化学兴趣小组在实验室发现一瓶氢氧化钠溶液,瓶口有少量白色固体且玻璃瓶塞打不开,这一情况激起了他们浓厚的兴趣,于是展开了如下探究:
(提出问题)瓶口白色固体的成分是什么?
(查找资料)(1)玻璃中含有二氧化硅(SiO2),试剂瓶身经抛光处理,不易反应,而瓶口和玻璃塞上的磨砂将二氧化硅裸露出来;
(2)二氧化硅能与氢氧化钠溶液反应,SiO2+2NaOH=Na2SiO3+H2O;
(3)硅酸钠(Na2SiO3)是一种白色固体,有很强的粘合性,可溶于水,溶液呈碱性:硅酸钠溶液能与强酸反应,如:Na2SiO3+2HCl=2NaCl+H2SiO3↓(白色):硅酸钠溶液能与氯化钙溶液反应:Na2SiO3+CaCl2=2NaCl+CaSiO3↓(白色)。
(作出猜想)白色固体的成分是:
I.硅酸钠
Ⅱ.硅酸钠和碳酸钠;
Ⅲ.硅酸钠、碳酸钠和氢氧化钠。
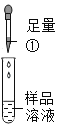
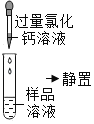
(实验探究)取一定量白色固体溶于适量水中形成样品溶液,分组进行如下实验并相互评价:
实验操作 | 实验现象 | 结论评价 | ||
第 一 组 |
| 有气泡冒出,且产生白色沉淀 | 同学们认为猜想I②_____(成立或不成立):写出生成气体的化学方程式③________ | |
第二组 | 第一步 |
| 产生白色沉淀 | 第1组同学认为:此步骤还不能准确判断出原固体的成分 |
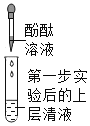
第二步 |
| ④_______ | 大家一致认为:猜想Ⅱ成立 | |
(反思交流)
(1)第2组实验第一步中加入过量氯化钙的作用是⑤_____。
(2)有同学认为,第2组实验中不能用氢氧化钙溶液代替氯化钙溶液,理由是⑥_____。
(3)氢氧化钠溶液必须密封保存,且试剂瓶只能用⑦_____。