【题目】化学兴趣小组在老师的帮助下探究氢气的燃烧实验。

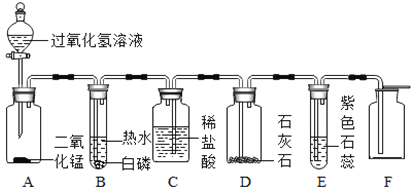
(1)用锌和稀硫酸制取氢气,从图甲中选择仪器组装一套便于添加液体药品的发生装置,所需仪器为_______(填仪器编号);仪器B的名称是________。
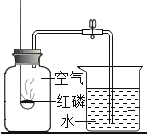
(2)按图乙操作研究氢气的燃烧实验,需用试管收集不同体积比的氢气与空气的混合物,现用(1)中组装的正确装置制取氢气,如何用试管(假设试管容积为10mL)收集氢气与空气体积比为4:1的混合气体,写出其操作方法:______。
(3)用不同体积比的混合气体做氢气的燃烧实验,结果如表:
序号 | 氢气与空气体积比 | 点燃现象 |
1 | 9:1 | 安静燃烧 |
2 | 8:2 | 安静燃烧 |
3 | 7:3 | 弱的爆鸣声 |
4 | 5:5 | 强的爆鸣声 |
5 | 3:7 | 强的爆鸣声 |
6 | 1:9 | 弱的爆鸣声 |
7 | 0.5:9.5 | 不燃烧不爆鸣 |
分析上表信息,你对燃烧或燃烧条件的新认识是________。