【题目】实验课上,老师知道某兴趣小组进行粗盐提纯的实验,邀请你帮助他们完成下面的实验报告。
(实验名称)粗盐的提纯
(查阅资料)
(1)粗盐中含有泥沙及少量可溶性MgCl2、CaCl2、Na2SO4等杂质。
(2)Ba(OH)2是一种易溶于水的强碱。
(主要玻璃仪器)量筒、烧杯、漏斗、玻璃棒、胶头滴管、酒精灯
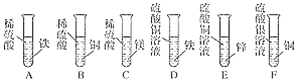
(主要试剂)粗盐样品、稀盐酸、BaCl2溶液,NaOH溶液,Na2CO3溶液,蒸馏水
(实验过程)
步骤及目的 | 过程及说明 |
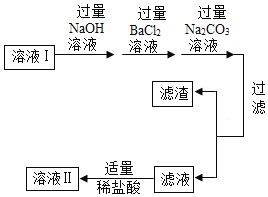
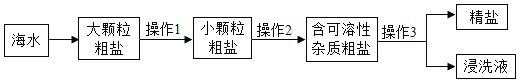
一、去除粗盐 中的泥沙 | 1.称取粗盐样品10.0g,用蒸馏水充分溶解 2.过滤去除泥沙的溶液I 以上两步操作中均需要使用到玻璃棒,玻璃棒的作用分别是:溶解时:____; 过滤时:____。 |
二、去除可溶 性杂质 | 将溶液I按如图流程图进行处理:
1、加入“过量NaOH溶液时”,发生反应的化学方程式是____。 2、过滤后,所得的滤渣成分有____种。 3、判断“稀盐酸适量”的方法是____。 |
三、获得产品 | 将溶液Ⅱ注入____(填仪器名称)中,蒸发结晶,观察到____,停止加热,利用余热蒸干。装置完全冷却后,获得干燥的产品9.4g。 |
四、数据处理 | 该粗盐样品中氯化钠的质量分数是94% |
(结果与反思)
(1)实验操作、试剂和装置均不存在问题,老师却指出该样品中氯化钠的质量分数不是94%,原因是____。
(2)小明提出,如果步骤二中只调换“过量的NaOH溶液”与“过量的BaCl2溶液”的加入顺序,对除杂结果也不会产生影响,你____(填“同意”或“不同意”)小明的观点。
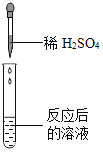
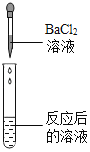
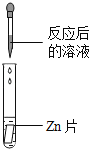
【题目】碳酸氢钠是小苏打的主要成分,在生产和生活中有许多重要的用途。化学课上,同学们为了解碳酸氢钠的性质,将一定质量的碳酸氢钠和稀硫酸混合,充分反应后,有气体逸出,写出该反应的化学方程式_____,同学们对反应后溶液中溶质的成分进行了探究:认为除一定含有硫酸钠外可能还含有其他成分,因此进行了猜想并做了如下实验:
(实验用品)pH试纸、锌片、氧化铜粉末、稀硫酸、氢氧化钠溶液、氯化钡溶液。
(猜想与假设)反应后溶液中溶质的可能组成成分。
猜想一:硫酸钠
猜想二:硫酸钠、碳酸氢钠
猜想三:硫酸钠、硫酸
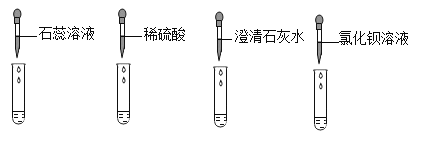
(实验探究)同学们取反应后的溶液用不同方案进行如下实验,请根据结论完成如表实验现象中的空格。
实验方案 | A | B | C | D |
实验操作 |
|
|
|
|
实验现象 | _____ | 产生白色沉淀 | 试纸变色,对照标准比色卡,pH<7 | _____ |
实验结论 | 猜想二不正确 | 猜想三正确 | 猜想三正确 | 猜想三正确 |
(得出结论)猜想三正确。
(评价反思)
(1)老师对同学们能用多种方案进行探究,并且得出正确的实验结论给予了肯定,同时指出探究中存在一处明显的操作错误是_____。
(2)有同学对实验方案B的结论提出了质疑,认为仅凭此现象不能得出猜想三正确,请说明理由_____。
(总结提高)依据所给实验用品,设计与上述实验不同的方案,确认猜想三是正确的,请你写出你的实验方案_____。
【题目】足球比赛中让意外昏迷的球员快速恢复意识会用到“嗅盐”。同学们对“嗅盐”产生了好奇,并对其成分进行了如下探究。
(查阅资料)①嗅盐是一种盐类物质和香料(不参与下列探究中的任何反应)组成,能释放出氨味气体,对人体神经会产生强烈的刺激作用,但过量吸入会危害健康。
②氯化钙稀溶液与碳酸氢铵溶液不发生反应。 ③氨气能与硫酸化合生成硫酸铵。
(提出问题)嗅盐中盐类物质是什么?
(实验探究)填写表中空格。
实验 | 小军的实验 | 小英的实验 | |
方案 |
嗅盐与___(填一种物质)混合研磨 |
|
|
现象 | 闻到较浓烈刺激性气味且试纸变蓝 | ______ | ______ |
结论 | 嗅盐中含有NH4+ | 嗅盐中含有CO32- | 确认了小军的实验结论 |
证明嗅盐中盐类物质是碳酸铵 | |||
(质疑)小英认为小军的实验不严谨,小英通过补做一个实验(方案见上表),进而确认了小军的结论。小英的实验目的是排除嗅盐中的_______离子可能性。
(继续探究)同学们利用如图装置进一步测定嗅盐中碳酸铵的质量分数。

反应原理:![]() ,其中X的化学式为______。
,其中X的化学式为______。
(数据记录)实验秤取样品质量m1,反应前后装有氢氧化钠固体的球形管的总质量分别为m2和m3,反应前后烧杯及烧杯内溶液的总质量分别为m4和m5。
(数据处理)通过测得数据计算出嗅盐中碳酸铵的质量分数。
(反思与评价)关于该实验的说法正确的是______(填序号,双选)
A 嗅盐中碳酸铵的质量分数表达式为:![]()
B 倒置漏斗可以增大吸收面积同时防止倒吸
C 可以用浓硫酸代替稀硫酸
D 停止加热一段时间后要通入一段时间空气,否则测定结果会偏小
【题目】材料一:候德榜是我国著名的化学家,发明了侯氏制碱法,为纯碱和氮肥工业技术的发展作出了杰出的贡献。下面是实验室模拟侯氏制碱法原理的生产过程:

①20℃时,将CO2通入含NH3的饱和NaCl溶液中,生成 NaHCO3晶体和NH4Cl溶液。
②将①中的产物 NaHCO3晶体充分加热分解,得到Na2CO3、H2O和CO2。
材料二:20℃时几种物质在水中的溶解度/g
NaCl | NH4Cl | NaHCO3 |
36.0 | 37.2 | 9.6 |
请回答下列问题:
(1)在第①步反应中,有 NaHCO3晶体析出,而没有NH4Cl和NaCl晶体析出的原因是_____。
(2)该生产过程中部分生成物可作为原料循环使用的是_____,同时得到的副产品NH4Cl是一种氮肥。