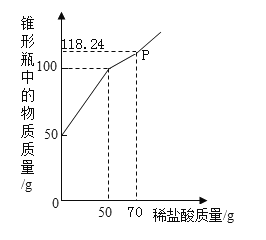
【题目】鸡蛋壳(主要成分为碳酸钙)是一种良好的钙源,可作为畜禽钙添加剂,促进畜禽生长发育。为测定某鸡蛋壳样品中碳酸钙的含量,称取该样品26g放入烧杯中,将219.0g稀盐酸分4次加入烧杯中,产生气体的情况如下表:
次数 | 第1次 | 第2次 | 第3次 | 第4次 |
稀盐酸的质量/g | 73 | 73 | 36.5 | 36.5 |
气体的质量/g | 4.4 | 4.4 | 2.2 | 0 |
(1)生成气体的总质量为______g。
(2)请计算鸡蛋壳中碳酸钙的质量分数_________(写出计算过程,结果精确到0.1%)。
【题目】取暖贴是冬季常用的一种防寒用品,可快速缓解并消除各种畏寒疾病引起的疼痛,图示为某品牌取暖贴,小明剪开内包装袋,倒出其中的粉末,发现呈黑色,该黑色固体粉末的主要成分是什么呢?

(作出猜想)该黑色粉末可能含有炭粉、铁粉、氧化铜、二氧化锰中的一种或几种。
(进行实验)为了确定该黑色粉末的成分,小组同学又进行了如下实验:
实验操作 | 实验现象 | 实验结论 |
①取少量黑色粉末于试管中并加入过量的稀硫酸 | 固体部分溶解,有气泡产生,溶液变为浅绿色 | 该黑色粉末肯定含有_______,肯定不含__________ |
②取实验①的残渣灼烧,将内壁涂有澄清石灰石灰水的小烧杯罩在上方 | 澄清石灰水变浑浊 | 该黑色粉末肯定含______ |
(反思评价)(1)实验①中发生反应的化学方程式为__________。
(2)小明查阅资料知道,取暖贴发热是因为铁粉在氯化钠和水的作用下能加快氧化,放出热量。该过程是将化学能转化为__________能。
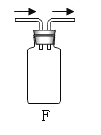
(拓展创新)小明利用该原理,设计如图所示实验装置,探究碳粉对铁锈蚀速率的影响进行实验,观察到量筒内水沿导管慢慢进入广口瓶(净容积为146mL),当温度恢复至室温且量筒内水面高度不变时读数,数据记录如下:
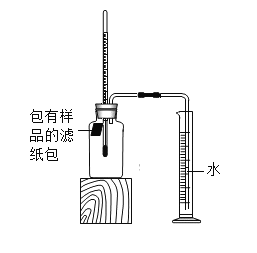
序号 | 样品 | 量筒起始读数/mL | 量筒最终读数/mL | 所需时间/mL |
① | 1g铁粉、0.2g碳、10滴水和少量NaCl | 100 | 70 | 约70 |
② | _________ | / | / | / |
【题目】电石是一种重要的化工原料。同学们借助网络资源和化学实验对电石的性质和变化进行如下的科学探究,请你也参与其中。
(查阅资料)
①电石的主要成分为碳化钙(化学式为CaC2),碳化钙与水反应生成一种白色固体和一种可燃性气体。
②将紫甘蓝汁液分别滴入下列液体中,显示的颜色如下表:
液体名称 | 白醋 | 食盐溶液 | 肥皂水 | 纯碱溶液 |
紫甘蓝汁液显示的颜色 | 红色 | 蓝紫色 | 蓝色 | 绿色 |
(作出猜想)根据碳化钙及水的组成推测:①碳化钙与水反应生成的白色固体可能是___________(写出两种物质)。
②碳化钙与水反应生成的可燃性气体可能是H2、CH4或C2H2(乙炔)。
(实验探究)同学们在老师的指导下,按如下步骤进行实验:
(1)取适量的电石加水,剧烈反应,放出大量的热,产生无色气体。
(2)收集反应生成的气体,验纯后点燃,发现气体燃烧时产生黄色火焰并伴有浓烈黑烟,因此该气体不可能是_____________。
(3)分别取反应生成的白色固体于两支试管中,进行如下的操作:
实验操作 | 实验现象 | 实验结论 |
①向一支试管中滴加足量的稀盐酸 | 固体溶解,但无气体产生 | 白色固体是________ |
②向另一支试管中加入适量的水,振荡、静置,再向上层清液中滴加_________ | 溶液变为绿色 |
(实验结论)碳化钙与水反应的化学方程式为___________。
(问题交流)
(1)存放电石的库房若发生火灾,___________(填“能”或“不能”)用水扑救。
(2)乙炔(C2H2)含碳量极高,它在空气中燃烧会冒出浓厚的黑烟(炭黑)。要使乙炔气体充分燃烧,常采用的方法是_____________。
【题目】活性炭可处理大气污染物NO,在一定条件下向密闭容器中加入NO气体和活性炭,反应生成甲、乙气体,测得各物质的质量如下表所示。下列说法正确的是()
反应时间/min | 活性炭 | NO | 甲 | 乙 |
0 | 24.36 | 3 | 0 | 0 |
2 | 24 | 1.2 | x | 1.32 |
A.x的值为2.88
B.反应中活性炭只起吸附作用
C.该反应属于置换反应
D.生成甲、乙气体的分子个数比为1:2
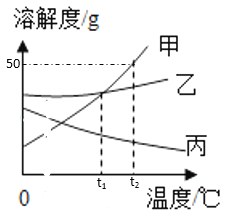
【题目】下表是NaCl和Na2CO3在不同温度下的溶解度,下列说法中不正确的是( )
温度/℃ | 0 | 10 | 20 | 30 | 40 | |
溶解度/g | NaCl | 35.0 | 35.5 | 36.0 | 36.5 | 37.0 |
Na2CO3 | 6.0 | 10.0 | 18.0 | 36.5 | 50.0 | |
A. 两种物质溶解度相等的温度在30℃
B. 生活在盐碱湖附近的人们习惯“夏天晒盐、冬天捞碱”
C. 40℃时,5gNaCl中加10g水可得溶质质量分数为26.3%的溶液
D. 40℃时,9g Na2CO3中加20g水,充分溶解后再降温到10℃,析出固体的质量为7g