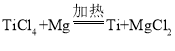【题目】19世纪末,科学家瑞利通过如下两种方法制得氮气,并测得其密度,从而获得科学史上的重大发现。请你参与以下的科学发现过程。
方法I:利用空气分离出氮气
实验步骤 | 解释或结论 |
(1)将清新洁净的空气通过NaOH溶液,再通过浓硫酸。 | 通过浓硫酸的 目的是为了除去空气中的_____________。 |
(2)将气体通过能与氧气反应的物质(提示:反应不能生成新的气体) | 请写 出一种能用于除去氧气的物质____________。 |
(3)收集剩余气体,并测定该气体的密度。 | 密度: 1.2572g/L |
方法Ⅱ:用亚硝酸钠(NaNO2)和氯化铵(NH4Cl)反应制取氮气,同时还生成了氯化钠和一种常见的液态物质(反应装置如下图所示,其中B部分的冰盐起冷凝作用)。测得氮气的密度为1.2508g/L.该反应的化学方程式为_____________________________。
[实验验证]实验小组同学采用方法Ⅱ测定氮气的密度,操作步骤如下:
① 20°C时,经过必要的实验操作后,取含NH4Cl固体0.214g的饱和NH4Cl溶液放入烧瓶,连接装置;
② 调节水准管,使其与量气管中液面相平,记录量气管中水面读数为10.0mL;
③打开分液漏斗的活塞,逐滴滴入饱和NaNO2溶液,加热至反应发生,移走酒精灯:
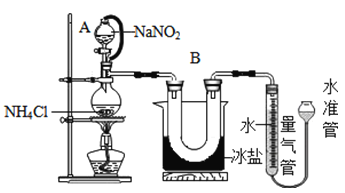
④ 烧瓶中不再产生气泡时,关闭分液漏斗A的活塞;
⑤待冷却至室温,调节两边液面高度相平,记录量气管中水面读数为100.0mL;
⑥处理剩余药品,整理实验台。
[实验分析及数据处理]
(1)步骤①中加入药品前必须进行的实验操作是_________________;
(2)步骤③中移走酒精灯后,实验可持续进行的原因是_________________;
(3)计算该实验中生成的氮气的密度为___________________g/L(保留4位小数)
[解释与结论]瑞利(Rayleigh)发现,采用方法Ⅰ得到的氮气在相同条件下比其他方法得到的纯氮气密度总是偏大0.5%~ 0.6%。若实验设计与操作均无错误,且氮气已完全干燥,请解释产生这一现象的原因是________________;(已知:相同条件下,气体的相对分子质量越大,密度就越大)
[反思与评价]
(1)装置中A部分的分液漏斗与蒸馏烧瓶之间连接的导管所起的作用是____
A 防止NaNO2饱和溶液蒸发
B 保证实验装置不漏气
C 使NaNO2饱和溶液顺利滴下
D 使测得的N2体积更准确
(2)科学家瑞利仅仅是从小数点第三位数的差别,发现了新物质。这启示我们在今后的学习和生活中要学习科学家的______________。
A 严谨求实的科学态度和敢于怀疑的批判精神
B 科学研究中遇到疑惑就趁早放弃,不要浪费时间
C 不能因为微小的差异而放过一次成功的机会
D 要相信权威,权威一定是正确的
(3)在实验室中,我们也可将氨气通过炽热的装有氧化铜的硬质玻璃管,生成铜、氮气和水蒸气,该反应的化学方程式为_______________________,若实验操作正确,除去水蒸气,经过精确测定,用该方法测得的氮气密度数值应与上述方法__________________ (填“I”或“II”)的更接近。
【题目】根据如图回答问题。

(1)仪器a的名称是________________;
(2)实验室制取二氧化碳的发生和收集装置是_________________;发生反应的化学方程式为_____________;若该实验需要制取44g二氧化碳,实验室只有100g 大理石和足量稀盐酸,请通过计算说明能否完成实验任务? _________________;
(3)实验室用A装置制氧气的化学方程式为__________________。装置E中的实验现象是____________________;发生反应的化学方程式为___________________。
(4)探究带火星的木条在不同体积分数氧气中的复燃情况,部分实验数据记录如表所示。
氧气体积分数(%) | 30 | 40 | 60 | 70 |
带火星的木条 | 不变 | 稍亮 | 复燃 | 复燃 |
在集气瓶中注入占其容积50%的水(如图F所示),用排水法收集完氧气后,将带火星的木条伸入该集气瓶中,推测实验现象为_________________。
【题目】某兴趣小组的同学对错的某些性质进行相关探究。
[提出问题]铝能否与水反应生成氢气?
物质 | 钠与水 | 铝与水 | 汞与水 |
能否发生反应 | 能反应 | 能反应 | 不反应 |
[查阅资料]如图:
[交流与讨论]
(1)铝在空气中与氧气反应形成保护膜,写出铝与氧气反应的化学方程式_____________________。
(2)要除去铝表面氧化铝薄膜,可以将铝片漫入氯化汞( HgCl2)溶液中,形成铝汞齐(铝汞合金)破坏铝表面致密的氧化膜且防止其重新生成。铝与氯化汞溶液发生置换反应的化学方程式为______________________。
[实验探究]
(1)将铝片完全浸入氯化汞(HgCl2)溶液中1分钟左右后取出。立即用水冲洗干净后加入到蒸馏水中,表面生成大量气泡,周围出现白色沉淀。在导管口处涂肥皂水,发现有气泡形成。用燃着的木条点燃气泡,发出爆鸣声,对应化学方程式为_____________________。
[实验结论]铝能与水反应生成氢气。
请写出铝与水反应生成氢氧化铝和氢气的化学方程式_____________________。
[实验反思]
(1)若反应使用如图装置,关闭导管上的活塞K,反应停止,其原理是_____________________。当再次打开活塞K,反应继续,产生气泡。铝未能生成氧化铝,其原因是_____________________。