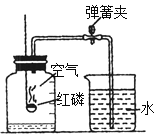
【题目】某兴趣小组同学对实验室制备氧气的条件进行如下探究实验.
(提出问题)
①氧化铜是否也能作氯酸钾分解的催化剂?②它是否比二氧化锰催化效果更好?
(设计并完成实验)
Ⅰ.将3.0g氯酸钾放在试管中加热
Ⅱ.将3.0g氯酸钾与1.0g二氧化锰均匀混合加热
Ⅲ.将x g氯酸钾与1.0g氧化铜均匀混合加热
(实验现象分析)
Ⅲ中x的值应为_____;将实验Ⅰ和Ⅲ比较可证明_____;将实验Ⅲ反应后的固体加水溶解、过滤、洗涤、干燥,若称量得到1.0g黑色粉末,再将黑色粉末和xg氯酸钾混合加热,现象与实验Ⅲ相同,此步骤是为了证明氧化铜在该化学反应前后_____和_____都不变.
(结论)氧化铜还能作氯酸钾分解的催化剂。
(实验反思)实验Ⅱ和Ⅲ对比是为了证明_____。
(提出问题)②双氧水分解速度还和什么因素有关
(设计并完成实验)
双氧水的质量 | 双氧水的浓度 | MnO2的质量 | 相同时间内产生产生O2体积 | |
Ⅰ | 50.0g | 1% | 0.1g | 9mL |
Ⅱ | 50.0g | 2% | 0.1g | 16mL |
Ⅲ | 50.0g | 4% | 0.1g | 31mL |
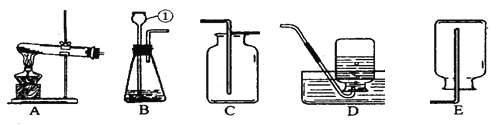
本实验中,测量O2体积的装置是_____(填编号)
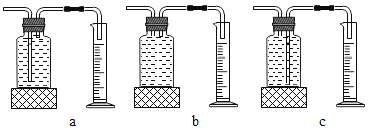
(结论)在相同条件下,双氧水的浓度越大,双氧水分解得越_____。