【题目】为了测定某品牌纯碱(杂质为氯化钠)中碳酸钠的质量分数,进行了如下实验:
①在三个烧杯中分别加入12.0g样品及足量的水配成溶液;
②向三个烧杯中分别加入一定质量的10.0%氯化钙溶液;
③将充分反应后生成的沉淀过滤、洗涤、干燥,并称量得到的白色固体。
实验所得数据见下表:
烧杯Ⅰ | 烧杯Ⅱ | 烧杯Ⅲ | |
加入10.0%氯化钙溶液的质量(g) | 55.5 | 120.0 | 150.0 |
白色固体的质量(g) | 5.0 | 10.0 | 10.0 |
请回答:
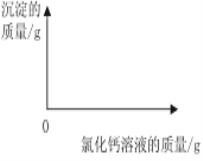
(1)12g样品中生成沉淀________g。
(2)样品中碳酸钠的质量分数是________?(写出计算过程,结果精确到0.1%)
(3)在如图中绘制出白色沉淀与加入氯化钙溶液的质量关系图___________(图上要注明白色沉淀、氯化钙溶液的相关质量)。
【题目】某化学兴趣小组发现铜片在加热的条件下可以与浓硫酸反应,产生气泡并闻到刺激性气味,铜片溶解,溶液呈蓝色,请你参与实验探究。
(提出问题)产生的气体是什么?
(查阅资料)SO2是一种无色,有刺激性气味,有毒的气体
(提出猜想)猜想一:SO2;猜想二:SO2和H2;猜想三:SO2和CO2。你认为猜想二____(填:“正确”或“错误”),同时,猜想三不可能的原因是_____。
(提出问题)蓝色溶液的溶质是什么?
(提出猜想)猜想一:CuSO4;猜想二:CuSO4和H2SO4。
(进行实验)取一定量反应后的溶液进行稀释,并分装在A、B两支试管中,然后进行下列实验,并完成下表:
步骤 | 实验操作 | 实验现象 | 实验结论 |
步骤一 | 在试管A中加入少量的CuO粉末 | ______________ | 溶液中含有H2SO4 |
步骤二 | 在试管B中加入过量的NaOH溶液 | ______________ | 溶液中含有CuSO4 |
(探究结论)通过实验,猜想二正确。
(1)写出步骤一发生反应的化学方程式:___________________________。
(2)完成并配平方程式:Cu+H2SO4(浓)________________________。
(反思评价)根据化学方程式:小王认为工业上可以用铜和浓硫酸反应大量制取硫酸铜,小李认为不适宜,理由是_________________________。