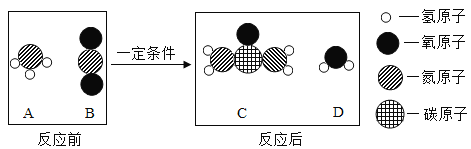
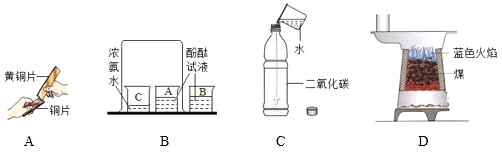
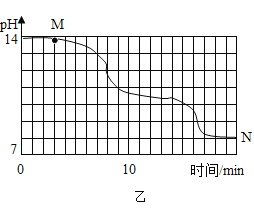
【题目】生活中铜器保存不当易生成铜锈,又称铜绿,其主要成分是碱式碳酸铜(Cu2(OH)2CO3),碱式碳酸铜是一种用途广泛的工业原料。
(1)根据铜绿的化学式推断,铜生锈的条件除了水和氧气外,还需要_________(填化学式).
(2)铜绿不稳定,在加热的条件下生成氧化铜、水和二氧化碳,写出该反应的化学方程式 ____。
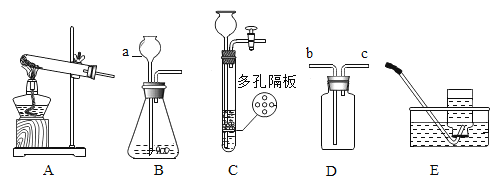
(3)用甲、乙、丙三套装置组合后检验铜绿分解的生成物中有水和二氧化碳,仪器的接口顺序为e- ____— __— ___。(资料链接:无水硫酸铜遇水变蓝色)
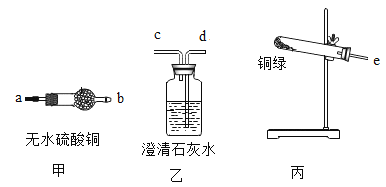
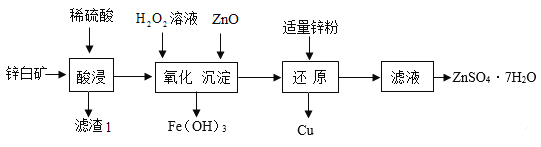
(4)用辉铜矿(主要成分为Cu2S,还含有少量Fe2O3、SiO2 杂质)制备铜绿流程如下:
①部分金属阳离子生成氢氧化物沉淀的 pH 范围如下表所示。调节 pH,使Fe3+完全沉淀而Cu2+不沉淀,则 pH 的范围应控制在 _____。
氢氧化物 | Mn(OH)2 | Fe(OH)3 | Cu(OH)2 |
开始沉淀的pH | 8.3 | 2.7 | 4.4 |
完全沉淀的pH | 9.8 | 3.7 | 6.4 |
②(Ⅱ)因为辉铜矿中含有少量Fe2O3,Fe2O3可与稀硫酸反应,故反应池中发生的反应还有:
(Ⅰ)2MnO2+Cu2S+4H2SO4=S+2CuSO4+2MnSO4+4H2O。
_____。
③结晶池中温度须控制在 70℃-80℃,如果出现_________(填写实验现象),说明温度过高。
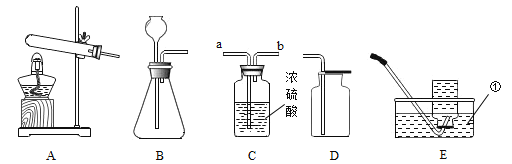
(5)为了从某铜绿样品中制得金属铜,同时测定碱式碳酸铜的含量。小王同学设计了如下图所示的实验装置,回答下列问题:(资料链接:无水碳酸铜遇水变蓝色)
Ⅰ.实验开始时,应先_________再_________(填序号),观察到玻璃管中出现红色固体。
①通入H2 排尽空气 ②点燃酒精灯加热
Ⅱ.碱式碳酸铜晶体化学式:CuCO3·Cu(OH)2·2H2O,相对分子质量为 258。若样品为 20g,反应结束后 B、D 装置分别增重 2.7g 和 2.2g。
计算:①生成二氧化碳 _____g。
②该样品中碱式碳酸铜晶体的纯度。________(写出计算过程,保留到小数点后一位)
【题目】乙醇在常温常压下是一种易燃、易挥发的无色透明液体。现将 4.6gC2H5OH 与一定量的氧气置于密闭容器中,通过电火花点火,乙醇完全反应,容器内具体数值见下表。根据表格提供的数据, 下列说法错误的是
C2H5OH | O2 | CO2 | M | H2O | |
反应前质量(g) | 4.6 | a | 0 | 0 | 0 |
反应后质量(g) | 0 | 0 | 4.4 | b | c |
A.c 的数值为 5.4
B.M 中一定有碳元素
C.当 a≧9.6 时,产物中将不会有 M
D.当 a 的值在合理范围内发生变化时,b、c 的值也随之变化