【题目】氢氧化镁是一种重要的化工原料,某矿石由MgO、Fe2O3、CuO和SiO2组成。用它制备氢氧化镁的流程示意图如下:

部分金属阳离子以氢氧化物形成沉淀时溶液的pH见下表:
沉淀物 | Fe(OH)3 | Cu(OH)2 | Mg(OH)2 |
开始沉淀 | 1.9 | 4.2 | 9.1 |
完全沉淀 | 3.2 | 6.7 | 11.1 |
(1)熟石灰主要成分的化学式是____________。
(2)溶液A中的阳离子是___________________(填离子符号)。
(3)沉淀C的成分是_____________________。
(4)溶液B与熟石灰反应的化学方程式是____________________________________。
【题目】硫酸锂(Li2SO4)和硝酸钾在不同温度时的溶解度如下表:
温度/℃ | 0 | 10 | 20 | 30 | 40 | |
溶解 度/g | Li2SO4 | 36.1 | 35.4 | 34.8 | 34.3 | 33.9 |
KNO3 | 13.3 | 20.9 | 31.6 | 45.8 | 63.9 | |
请回答下列问题:

(1)依据溶解度表,绘制溶解度曲线如图所示,其中能表示Li2SO4溶解度曲线的是_______(填“甲”或“乙”)。
(2)Li2SO4和KNO3在某一温度时具有相同的溶解度x,则x的范围是_________________。
(3)40℃时,有含少量Li2SO4的KNO3饱和溶液,欲从中提纯KNO3晶体,方法是________________。
(4)将10℃时两种物质的饱和溶液分别升温至30℃,所得Li2SO4溶液中溶质的质量分数__________(填“>”、“<”或“=”)KNO3溶液中溶质的质量分数。
(5)如图所示,20℃时,将盛有饱和Li2SO4溶液的试管放入盛水的烧杯中,向烧杯的水中加入某物质后,试管内有晶体析出。则加入的物质可以是______(填字母序号)。
①浓硫酸 ②冰块 ③生石灰固体 ④硝酸铵固体 ⑤氢氧化钠固体
A.②④ B.①③⑤ C.③④ D.①②⑤
【题目】活动小组为测定由氧化铜和铜组成的混合物中氧化铜的质量分数,现取3份该固体混合物各20g,分别缓慢加入到50 g、100 g、150 g某稀硫酸中,测得三组实验数据如下表:
组别 | 第1组 | 第2组 | 第3组 |
稀硫酸质量/g | 50 | 100 | 150 |
剩余固体的质量/g | 10.0 | 4.0 | 4.0 |
根据实验及有关数据进行分析与计算:
(1)第1组实验中_____________(填“氧化铜”“稀硫酸”或“氧化铜与稀硫酸”)完全反应。
(2)样品中氧化铜的质量分数是__________g。
(3)根据第1组实验数据计算所用的稀硫酸溶质的质量分数__________(写出计算过程)。
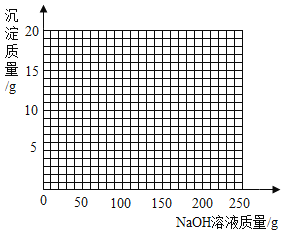
(4)若将第2组实验后的混合物过滤,在滤液中滴加10%的NaOH溶液,请画出在该混合溶液中加入10% NaOH溶液的质量与生成沉淀质量变化关系的曲线图__________。
【题目】化学兴趣小组的同学发现有一瓶氢氧化钠溶液没有塞橡皮塞,在老师指导下,开展了以下探究:
(提出问题1)该氢氧化钠溶液是否变质了呢?
(实验探究1)
实验操作 | 实验现象 | 实验结论 |
取少量该溶液于试管中,向溶液中滴加稀盐酸,并不断振荡。 | 有气泡冒出。 | 氢氧化钠溶液一定变质了。 |
(提出问题2)该氢氧化钠溶液是全部变质还是部分变质呢?
(猜想与假设)猜想1:氢氧化钠溶液部分变质。猜想2:氢氧化钠溶液全部变质。
(查阅资料)(1)氯化钙溶液呈中性。
(2)氯化钙溶液能与碳酸钠溶液反应:CaCl2+Na2CO3=CaCO3↓+2NaCl
(实验探究2)
实验步骤 | 实验现象 | 实验结论 |
(1)取少量该溶液于试管中,向溶液中滴加过量的氯化钙溶液,并不断振荡。 | 有________生成。 | 说明原溶液中一定有碳酸钠。 |
(2)取步骤(1)试管中的少量上层清液,滴加酚酞溶液。 | 溶液变红色。 | 说明原溶液中一定有_________。 |
(实验结论)该氢氧化钠溶液___________(填“部分”或“全部”)变质。
(反思与评价)
(1)氢氧化钠溶液露置于空气中容易变质,发生反应的化学方程式是_______________。
(2)在上述(实验探究2)中,小明提出可用氢氧化钙溶液代替氯化钙溶液,你认为该方案____(填“可行”或“不可行”)。
(理解与应用)氢氧化钠溶液容易变质,必须密封保存。实验室必须密封保存的药品还有很多,试另举一例:_________________________________________。