【题目】鸡蛋壳的主要成分是碳酸钙。为了测定某鸡蛋壳中碳酸钙的质量分数,小军同学进行了如下实验:
将鸡蛋壳洗净、干燥并捣碎后,与足量稀盐酸在烧杯中反应(假设鸡蛋壳中杂质不与稀盐酸反应)。
有关实验数据如表:
反应前 | 反应后 | ||
实验 数据 | 稀盐酸的质量 | 鸡蛋壳的质量 | 剩余物的质量 |
100g | 12g | 108.7g | |
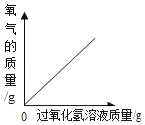
(1)根据质量守恒定律可知,反应中产生二氧化碳气体______g。
(2)计算该鸡蛋壳中碳酸钙的质量_____。
【题目】小明同学在一次实验中将氯化钠溶液加入到稀硫酸(H2SO4) 中没有观察到明显现象,而将混合溶液加热一段时间后,意外地闻到刺激性气味。
[提出问题]有刺激性气味的气体是什么?
[猜想与假设]猜想1:可能是二氧化硫;
猜想2:可能是氯化氢;
猜想3:可能是氨气。依据质量守恒定律,可判断猜想_____________不合理。
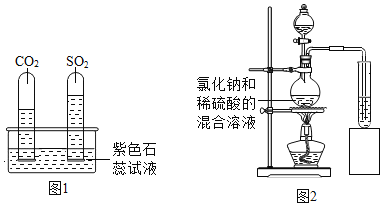
[查阅资料]①SO2和CO2的化学性质相似,都能使澄清石灰水变浑浊,氯化氢不能使澄清石灰水变浑浊;②SO2、CO2 和HCI的水溶液都显酸性,石蕊遇到酸性溶液变红。
(1)写出二氧化碳与石灰水反应的化学方程式_________________。
(2)如图1,将两支大小相同的收集满SO2和CO2的试管同时倒立于水槽中,一段时间后, 实验现象如图所示,说明在相同条件下的溶解性:SO2______________________(填“>”或“<”) CO2。
[实验探究]如图2,小明将产生的气体通入紫色石蕊溶液中,观察到______________,于是他认为猜想2正确。小丽认为小明的结论不科学,原因是_____________。
[实验改进]请你利用提供的试剂,设计实验确认猜想2正确。
试剂:稀硫酸、澄清石灰水、氯化钠溶液、硫酸铜溶液、紫色石蕊溶液。
实验操作 | 实验现象 | 结论 |
如图,将产生的气体_______________ | ______________ | 猜想2成立 |
[拓展应用]实验室可用氯化钠和硫酸反应制取氯化氢气体,已知氯化氢气体极易溶于水,请推测实验室制取氯化氢气体最适宜的方法为___________(填字母)
A加热氯化钠溶液和稀硫酸的混合物
B加热氯化钠固体和稀硫酸的混合物
C加热氯化钠固体和浓硫酸的混合物
【题目】为验证质量守恒定律,某学习小组做了镁条在空气中燃烧的实验(图1)。
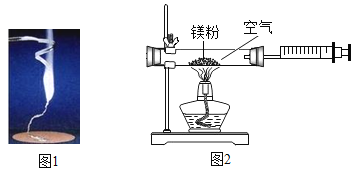
(1)请写出镁条与氧气反应的化学方程式_________________。
(2)小明认为根据质量守恒定律,燃烧产物的质量应大于反应物镁条的质量。镁条完全燃烧后,称量发现石棉网上的燃烧产物质量反而比反应前镁条质量小,其主要原因是______________。
(3)小红按图2装置改进实验,验证了质量守恒定律,却发现产物中还有一些黄色固体。
[查阅资料]①氧化镁为白色固体;
②镁能与氮气反应生成黄色的氮化镁(Mg3N2) 固体;
③氮化镁可与水反应生成氨气,氨气能使酚酞溶液变红。
[提出问题]黄色固体是什么呢?
[做出猜想]黄色固体为Mg3N2
[实验探究]
实验操作 | 实验现象及结论 |
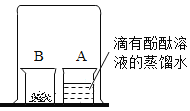
如图,取燃烧产物中的黄色固体于烧杯B中,加入适量水,然后用大烧杯罩住小烧杯A和B。
| 现象:____________。 结论:燃烧产物中含Mg3N2 |
[反思与交流]
空气中N2的含量远大于O2的含量,而镁条在空气中燃烧生成的MgO却远多于Mg3N2,请给出合理的解释______________。
[拓展延伸]
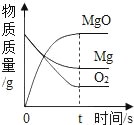
①根据题意,2.40g 镁条在空气中完全燃烧,所得固体质量为m,则m的取值范围____________。
②反思实验探究过程,谈谈你对物质燃烧条件的新认识__________。