【题目】叠氮化钠(NaN3)被广泛应用于汽车安全气囊,某兴趣小组对其进行下列研究.
(应用研究)
(1)汽车经撞击后,30毫秒内引发NaN3,迅速分解为Na、N2,反应方程式为_______。
(制备研究)
(2)将金属钠与液态氨反应得NaNH2,再将NaNH2与N2O反应可生成NaN3、NaOH和
气体X,该反应的化学方程式为2NaNH3+N2O = NaN3+NaOH+X,实验室检验X
气体使用的试纸是湿润________。
(Na2CO3质量分数测定)
工业级NaN3中常含有少量的Na2CO3,为测定样品中Na2CO3的质量分数设计如图装置(已知H2SO4溶液与NaN3,反应不生成气体)。

(3)装置A的作用是_____。设计的实验步骤为:①精确称量样品,检查装置气密性;②打开弹簧夹,鼓入空气,称量装置C;③关闭弹簧夹,打开分液漏斗活塞;④再打开弹簧夹,_______;⑤再次称量装置C。计算碳酸钠含量至少需要测定______(填数字)个数据。根据制备反应,分析工业级NaN3中含有Na2CO3的可能原因_______。
M |
(NaN3纯度测定)精确称量0.140 g NaN3样品,设计如图装置,测定其纯度。已知2 NaN3→ 3N2
(NaN3中的N全部转化为N2,其他产物略),反应中放出大量的热。

(4)检查该装置气密性的方法是连接好装置,从水准瓶注水,量气管中液面与右边液面形成高度差,做好标记,一段时间后,两边高度差_____(填“变大”、“变小”或“不变”),说明气密性良好。
(5)使小试管中的NaN3样品与M溶液接触的操作是______。
(6)使用冷水冷凝的目的是______。反应前应将液面调节到量气管的“0”刻度,并使两边液面相平,反应后读数时,还需要进行的操作是_______。
(7)常温下测得量气管读数为67.2 mL(N2的密度为1.25 g/L),则实验中选用的量气管规格合适的是_____(填字母序号)。
A. 100 mL B. 1 L C. 2 L
(8)计算NaN3样品的纯度(写出计算过程)。
【题目】几位同学对蜡烛燃烧火焰的焰心进行了以下探究。

请你完成其中的![]() 些步骤:
些步骤:
![]() 点燃蜡烛,将一根小木条迅速平放入火焰中,约1s后取出,现象如图A,这证明焰心______。
点燃蜡烛,将一根小木条迅速平放入火焰中,约1s后取出,现象如图A,这证明焰心______。
![]() 向焰心斜向插入一支细短玻璃管,发现玻璃管中无明显现象
向焰心斜向插入一支细短玻璃管,发现玻璃管中无明显现象![]() 如图
如图![]() ,在玻管的上口点燃,上口产生火焰,这说明焰心物质的性质是:_______。(写一条)
,在玻管的上口点燃,上口产生火焰,这说明焰心物质的性质是:_______。(写一条)
![]() 猜想和验证:
猜想和验证:
猜想 | 操作 | 现象 | 结论 |
假设①:焰心气体含 | 在未点燃的短玻璃管上口 ______。 | ______。 | 假设①不成立 |
假设②:焰心气体含有石蜡蒸气 | 取一较长的细玻璃管,用湿冷毛巾包住中部,将玻璃管下端插入焰心,上端试用火焰点燃。 | ______ | 假设②成立 |
取下长玻璃管,打开湿毛巾 | ______ |
![]() 若蜡烛的主要成分是石蜡,则其燃烧的反应文字表达式为:______。
若蜡烛的主要成分是石蜡,则其燃烧的反应文字表达式为:______。
【题目】某研究小组对过氧化氢溶液制取氧气进行如下探究。
实验一:氧气的性质实验
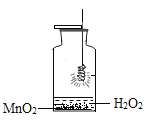
(1)如图所示是铁丝在氧气中燃烧的改进实验,用适量双氧水和二氧化锰代替原实验中集气瓶里的水。
①用双氧水和二氧化锰代替原集气瓶里的水,其优点除了使实验更简便外,还有________
②实验中可观察到到铁丝燃烧的现象是 ________,反应的文字表达式为 ________。
实验二:探究 H2O2 质量分数、溶液 pH、温度对反应速率的影响
(2)设计如下表实验方案:
实验序号 | H2O2 质量分 数/% | pH | 温度/ ℃ | 每分钟气泡数 |
1 | 30 | 5 | 20 | |
2 | 30 | 6 | 20 | |
3 | 30 | 11 | 20 | |
4 | 15 | 11 | 30 | |
5 | a | 11 | b |
①实验 1-3 的实验目的是________。
②a= ________;b= ________。
实验三:探究制取氧气的适宜催化剂
(3)实验方案如下:
I.用 MnO2、CuO、Fe2O3、Cr2O3 四种催化剂分别与海藻酸钠溶液混合,滴入氯化钙溶液制成含等质量催化剂、大小相同的海藻酸钠微球,备用。
II.取 30 粒含 MnO2 的海藻酸钠微球,采用下图装置进行实验。改用其他三种微球,分别重复上述实验,得到下图的锥形瓶内压强随时间变化的曲线图。
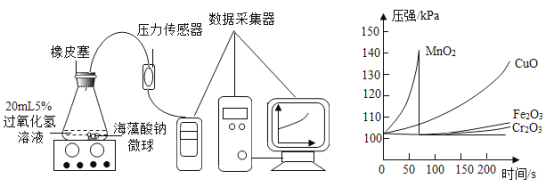
①每次实验时,海藻酸钠微球数应相同的原因________。
②用含 MnO2 的海藻酸钠微球进行实验,60s 时压强瞬间回落,其原因是________
③从实验曲线看,催化效果较好、反应温和的催化剂是________。