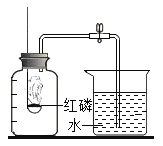
【题目】实验室常用加热氯酸钾与二氧化锰混合物的方法制取氧气。
I、写出该反应的化学方程式_________。
II、小芳发现,氯酸钾与氧化铜混合加热,也能较快产生氧气,于是进行如下探究:
(提出猜想)除MnO2、CuO外,Fe2O3也可以作KClO3分解的催化剂。
(完成实验)按下表进行实验,并测定分解温度(分解温度越低,催化效果越好)。
实验编号 | 实验药品 | 分解温度(℃) |
① | KClO3 | 580 |
② | KClO3、MnO2(质量比1∶1) | 350 |
③ | KClO3、CuO(质量比1∶1) | 370 |
④ | KClO3、Fe2O3(质量比1∶1) | 390 |
(分析数据、得出结论)
(1)由实验______与实验④对比,证明猜想合理;
(2)实验所用的三种金属氧化物,催化效果最好的是_________。
(反思)
(1)若要证明Fe2O3是该反应的催化剂,还要验证它在化学反应前后质量和_________不变;
(2)同种催化剂,颗粒大小可能影响催化效果,请设计实验方案进行验证:___________。
【题目】化学实验是学习化学的基础,请根据下列装置图回答问题。

(1)铁丝在氧气中燃烧的化学方程式为__________________。
(2)铁丝绕成螺旋状的原因是_________。
(3)小明按图示进行实验时,集气瓶炸裂了,其可能的原因是_____________。
(4)图中螺旋状铁丝的末端系一根火柴的作用是__________。
(5)为延长铁丝燃烧的时间,向盛有氧气的集气瓶中插入铁丝的方法是_________________。
(6)小明对铁丝在氧气中燃烧为什么会火星四射进行探究。下表是他将纯镁条和不同含碳量的铁丝(镁条和铁丝直径均为0.4 mm)放入氧气中燃烧时的实验现象的记录。请你分析后回答问题:
物质 | 镁条 | 含碳0.05%的铁丝 | 含碳0.2%的铁丝 | 含碳0.6%的铁丝 |
燃烧时的现象 | 剧烈燃烧,发出耀眼白光,无火星 | 剧烈燃烧,极少火星 | 剧烈燃烧,少量火星 | 剧烈燃烧,… |
①你认为表中未填的实验现象是_______。
②造成铁丝在氧气中燃烧时火星四射的主要原因是______。