【题目】某化学课堂围绕“酸碱中和反应”,将学生分成若干小组,在老师引导下开展探究活动。以下是教学片段,请你参与学习并帮助填写空格(包括表中空格)。
(查阅资料)Na2SO4溶液呈中性。
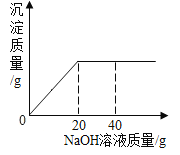
(演示实验)将一定量的稀硫酸加入到盛有无色酚酞和NaOH混合溶液的小烧杯中。当看到__(填现象),证明它们确实发生了化学反应。
(学生板书)该反应的化学方程式:____。
(提出问题)该烧杯内溶液中的溶质是什么?
(假设猜想)针对疑问,大家纷纷提出猜想。甲组同学的猜想如下:
①只有Na2SO4 ②有Na2SO4和H2SO4 ③有Na2SO4和NaOH ④有Na2SO4、H2SO4和NaOH
乙组同学对以上猜想提出质疑,认为有一种猜想是不合理的。不合理的猜想及理由是____。
(实验探究)
(1)丙组同学取烧杯中的溶液少量于试管中,滴加几滴CuSO4溶液,无明显变化,溶液中一定没有__。
(2)为了验证其余猜想,各学习小组利用烧杯中的溶液,并选用老师提供的pH试纸、铜片、BaCl2溶液、Na2CO3溶液,进行如下三个方案的探究。
实验方案 | 测溶液的pH | 滴加Na2CO3溶液 | 滴加BaCl2溶液 |
实验操作 |
|
|
|
续表:
实验现象 | 试纸变色,对比比色卡,pH<7 | 有气泡产生 | 产生白色沉淀 |
实验结论 | 溶液中有H2SO4 | 溶液中有H2SO4 | 溶液中有H2SO4 |
(得出结论)通过探究,全班同学一致确定猜想二是正确的。
(评价反思)老师对同学们能用多种方法进行探究,并且得出正确结论给予肯定。同时指出(实验探究)(2)中存在两处明显错误,请大家反思。同学们经过反思发现了这两处错误:
(1)实验操作中的错误是____。
(2)实验方案中也有一个是错误的,错误的原因____。
(反思与拓展)
(1)在分析化学反应后所得物质的成分时,除考虑生成物外还需考虑____。
(2)根据所学化学知识,验证烧杯内溶液中的溶质含有H2SO4,除以上正确方案外,下列哪些物质单独使用也能完成该实验?____(填序号)。①Cu ②CuO ③紫色石蕊溶液 ④AgNO3溶液
(3)烧杯中的溶液未经处理直接倒入下水道,可能造成的危害是____(写一条)。
【题目】根据下表进行实验,有关说法及分析错误的是
向少量KOH溶液中滴加CuSO4溶液 | 向少量BaCl2溶液中滴加CuSO4溶液 | |
现象 | ① | 白色沉淀 |
化学方程式 | 2KOH + CuSO4 =Cu(OH)2↓+ K2SO4 | ② |
A. ①有蓝色沉淀
B. ②反应的化学方程式为CuSO4 +BaCl2 =BaSO4↓+CuCl2
C. 两个反应都属于复分解反应
D. 只要有沉淀生成的反应就属于复分解反应
【题目】某化学兴趣小组的同学,为了比较金属R与铁、铜的金属活动性强弱,进行如下探究活动。
(进行猜想)对三种金属的活动性顺序做出如下猜想。
猜想一R>Fe>Cu
猜想二:_____
猜想三:Fe>Cu>R
(收集证据)为了验证哪一种猜想成立,甲、乙、丙三位同学分别展开实验探究。
主要操作 | 主要现象 | 实验结论 | |
甲 | 将打磨好的R丝插入盛有硫酸铜溶液的试管中 | _____ | 猜想一 正确 |
乙 | 将粗细相同打磨好的R丝、铁丝,分别插入体积和溶质质量分数都相同的稀盐酸中 | R丝表面产生气泡速率比铁丝表面产生气泡速率_____(填“快”或“慢”) | |
丙 | 将粗细相同打磨好的R丝、铁丝,分别在空气中点燃 | R丝在空气中剧烈燃烧,铁丝在 空气中不燃烧 |
写出R与盐酸反应化学方程式_____(R的化合价+2)
(交流反思)三位同学交流讨论后认为,比较金属活动性强弱的方法有多种。
(归纳总结)他们总结得出比较金属活动性强弱的常见方法有:
(1)金属与氧气反应的难易和剧烈程度;
(2)金属与_____是否反应或反应的剧烈程度;
(3)金属与_____是否反应。