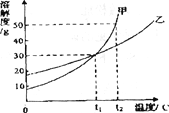
【题目】把A、B、C、D四种物质放在密闭容器中,在一定条件下充分反应,并测得反应物和产物在反应前后各物质的质量如表所示:
物质 | A | B | C | D |
反应前质量 |
|
|
|
|
反应后质量 | 待测 |
| 0 |
|
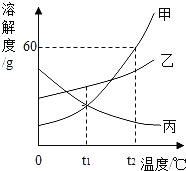
下列说法正确的是![]()
A. 物质C一定是反应物,物质D可能是单质
B. 反应后密闭容器中A的质量为![]()
C. 反应过程中,物质B和物质D变化的质量比为87:36
D. 若物质A与物质C的相对分子质量之比为194:216,则反应中A和C的化学计量数之比为2:1
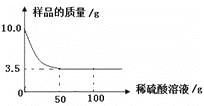
【题目】因二氧化碳能溶于水,并能与水反应生成碳酸,所以二氧化碳一般不用排水法收集。
二氧化碳气体究竟能否用排水法收集呢?某化学兴趣小组利用如图1所示的两套装置进行了深入地探究。

请写出石灰石与稀盐酸反应的化学方程式:______。
(定性实验)实验后,装置Ⅱ水槽中的液体应该呈酸性,向此液体中滴加紫色石蕊试液溶液颜色会变为______。但是取几次实验后的液体样品,滴加紫色石蕊试液,均无明显变色现象。对此你认为可能的原因是______。
(定量实验)采用数字化实验测定排水法和向上排空气法收集的二氧化碳纯净度的差异。因实验设备有限,本实验通过氧气传感器测出收集气体中残留的氧气(来自于空气),推算出空气的含量,再求出CO2的含量。请填写下列表格中相应的空白(精确到1%即可):
测得氧气含量 | 推算出CO2含量 | 结论 | |
排空气法 | 6.6% | 69% | 排水法收集到的二氧化碳更纯净 |
排水法 | 4.2% | ______ |
通过实验可知,若对CO2纯度要求较高,应该使用排水法收集二氧化碳。
(实验反思)利用装置I和装置Ⅱ收集到的二氧化碳都会混有少量空气,原因是______。
(交流讨论)证明排水法比排空气法所收集的二氧化碳气体纯度更高,还有什么方法?向两集气瓶中分别加入相同体积、相同浓度的澄清石灰水振荡,观察______。
(拓展应用)利用传感器对二氧化碳性质再探究。
步骤1:如图2所示装置的气密性良好,三瓶250mL的烧瓶内收集满CO2气体,三个注射器内各装有等体积的液体(分别是水、饱和石灰水、氢氧化钠浓溶液)。连接好装置和压强传感器。氟化钠和牙齿长得碳酸钙反应生成氟化钙保护层,使牙齿和酸性物质接触面积小,反应的碳酸钙少
步骤2:三位同学同时迅速将注射器内等体积的液体(水、饱和石灰水、氢氧化钠浓溶液)注入各自烧瓶中,关闭活塞。
步骤3:一段时间后,同时振荡烧瓶。观察传感器定量实时地传回烧瓶内气压变化形成的图象情况如图3所示。
(查阅资料)氢氧化钙微溶于水氢氧化钠易溶于水均可与二氧化碳发生反应。

(1)导致曲线AB段气压增大的主要原因是:注射器中液体加入烧瓶中时速度太快,而反应程度较小,导致压强______。
(2)图中曲线1中______段气压的变化是由于充分振荡烧瓶导致的。
(3)利用现有的装置,在不使用其他试剂的情况下,请你写出除振荡烧瓶外继续降低E点的操作方法______(或抽气等)。
(4)曲线2与曲线3差异较大的原因是饱和石灰水浓度太低(氢氧化钙微溶于水)影响了______。
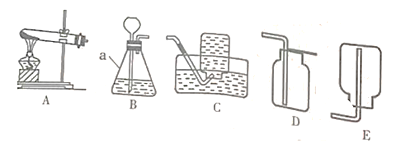
【题目】铁的化学性质比较活泼,能与氧气、酸、CuSO4溶液等多种物质发生化学反应。化学兴趣小组在课外资料中发现,铁和Fe2O3在高温条件下竟然也能发生化学反应。
(提出问题)
铁和Fe2O3反应的产物是什么?
(查阅资料)
①FeO、Fe2O3、Fe3O4中,Fe2O3是红棕色,其余是黑色;FeO在空气中会很快被氧化成Fe2O3;Fe3O4有磁性。②二氧化碳可用作该反应的保护气。③铁的氧化物都能与酸溶液反应。
(猜想与假设)
根据质量守恒定律,请你猜想铁和Fe2O3反应的产物:
①有FeO;②只有Fe3O4;③__________。
(进行实验)
(1)按下图装好药品(铁粉过量),连好仪器(装入药品前已检查装置的气密性)。
(2)轻推注射器活塞通入二氧化碳,估计玻璃管里空气________,停止通入二氧化碳。
(3)点燃酒精喷灯加热药品,等到固体粉末全部变黑,再熄灭酒精喷灯。

(4)当长柄V形玻璃管冷却至室温时,检验黑色粉末成分。检验过程如下(请填写表格中的空白):
检验操作及现象 | 检验结果 | |
a | 黑色粉末暴露在空气中不变化 | 黑色粉末中一定没有___________ |
b | 用磁铁靠近,黑色粉末能完全被吸引 | 黑色粉末中一定含有铁和_______ |
c | 取少量的黑色粉末装入试管,滴加足量的___________溶液,出现红色固体,充分反应后仍残留少许黑色粉末 | 确认猜想_______正确 |
(探究结论)
铁和Fe2O3能发生化合反应,有关的化学方程式是________________。
(反思评价)
本实验中的保护气,既能用二氧化碳气体,也能用________________。