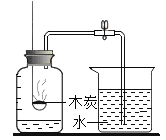
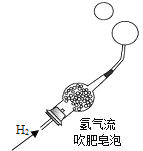
【题目】某化学兴趣小组的同学向无水乙醇中放入一小块金属钠,观察到有气泡产生。小组同学对这一现象产生了兴趣,进行了如下探究:
(提出问题)无水乙醇和金属钠反应产生的气体是什么?
(查阅资料)(1)无水乙醇(CH3CH2OH)和金属钠反应生成乙醇钠(CH3CH2ONa)和一种初中阶段常见的可燃性气体;
(2)浓硫酸具有较强的吸水性,可用作某些气体的干燥剂;
(3)白色的无水硫酸铜固体遇水后会变成蓝色。
(猜想与假设)猜想一:CO 猜想二:CH4 猜想三:H2
兴趣小组的同学提出上述猜想的理论依据是______。
(设计并实验)兴趣小组同学分成甲乙两组设计实验方案进行探究。
甲组同学设计的实验方案如下:

实验操作 | 实验现象 | 实验结论 |
将反应产生的气体点燃,在火焰上方罩一个干燥的冷烧杯 | 烧杯内壁有小液滴生成 | 猜想三成立 |
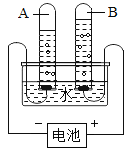
乙组同学认为只完成上述实验,猜想二也可能成立。理由是______。并设计了如下实验进步验证:将反应产生的气体点燃,燃烧产物依次通入A、B装置(如图),测得两装置实验前后的质量变化如下表。
A装置 | B装置 | |
实验前 | 257.6g | 144.2g |
实验后 | 257.8g | 144.2g |
乙组的同学根据实验数据分析,证明猜想______成立
(得出结论)无水乙醇与金属钠反应的化学方程式为______。
(实验反思)甲组同学受到乙组同学的启发,认为只需要增加个实验:再在火焰上方罩一个内壁蘸有澄清石灰水的烧杯,观察现象,就能使本组的实验方案更加完善。你认为此方案是否合理______(填 “合理”或“不合理”)。
(拓展延伸)要确认该实验过程中所用的乙醇是无水乙醇的实验方法是______。
【题目】下面是关于空气中氧气含量测定的再认识。

(1)(经典赏析)教材中介绍了拉瓦锡用定量的方法研究了空气的成分(实验装置如图1),该实验中选择使用汞的优点有_______。
A.实验过程中没有污染
B.生成的化合物加热分解又能得到汞和氧气
C.能将密闭装置内空气中的氧气几乎耗尽
(2)(实验回顾)实验室常用红磷燃烧的方法测定空气中氧气的含量(装置如图②),实验之前一定要_______,写出红磷燃烧的实验现象__________。兴趣小组用该方法测出的氧气含量常常远低于21%。
(提出问题)用红磷燃烧的方法为什么不能准确地测出空气中氧气的含量?
(3)(进行猜想)a.装置漏气;b.___________;装置内氧气有剩余;_______……
(4)有资料表明:燃烧过程中当氧气的体积分数低于7%,红磷就无法继续燃烧,因此通过上述实验,测量结果与实际误差较大。
(实验改进)(1)、用铁在潮温空气中生锈的反应来消耗瓶中氧气,设计如图3实验装置,再次测定空气中氧气含量。(装置中NaCl溶液、碳粉起加速铁生锈的作用)。
Ⅱ、测得实验数据如下表:
实验前 | 实验后 | ||
测量项目 | 烧杯中水的体积 | 集气瓶(扣除内容 物)和导管的容积 | 烧杯中剩余水的体积 |
体积/mL | 80.0 | 126.0 | 54.5 |
(交流表达)
①根据表中的数据计算,改进实验后测得的空气中氧气的体积分数是__________________(计算结果精确到0.1%)。
②从实验原理角度分析,改进后的实验结果比前者准确度更高的原因是:___________。(答出一点即可)