【题目】硝酸钾的部分溶解度数据见下表。
温度(℃) | 10 | 20 | 40 | 60 |
溶解度(g/100g 水) | 20.9 | 31.6 | 63.9 | 110 |
①20℃时,称取 10.0 克硝酸钾固体加入到 40 克水中,用_____(写出仪器名称)搅拌,充分溶解后得到_____(选填“饱和”或“不饱和”)溶液。
②将上述溶液升温至 60℃,所得溶液的溶质质量分数为_____。
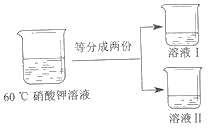
③将 60℃的硝酸钾溶液进行如图所示操作。
将溶液 I 降温,开始析出硝酸钾晶体的温度介于_____℃(选填编号之间。
A. 40-60 B. 20-40 C. 10-20 D. 低于 10
为得到 60℃时硝酸钾饱和溶液,将溶液 II 恒温蒸发 15 克水,请分析该操作能否达到实验目的并说明理由_____。
【题目】取四份大理石样品分别和稀盐酸反应,实验数据记录如下表。(杂质既不溶于水也不跟酸反应)
第1份 | 第2份 | 第3份 | 第4份 | |
大理石样品质量(g) | 3.0 | 3.0 | 3.0 | 3.0 |
稀盐酸质量(g) | 5.0 | 10.0 | 15.0 | 20.0 |
产生气体质量(g) | 0.44 | 0.88 | 0.99 | X |
回答下列有关问题:
(1)仔细观察第1份和第2份实验数据,会发现生成气体的质量不相同。据此判断,在第1份样品的实验中,_____(填“大理石”或者“稀盐酸”)完全反应;生成的气体通入澄清石灰水中,发生反应的化学方程式为_____;
(2)同理,比较第2份和第3份实验数据,可以判断其中第_____份大理石样品反应完全。那么,第4份数据中的x值应该为_____;
(3)计算:该大理石样品中碳酸钙的质量分数。___(依据化学方程式,写出计算过程)