【题目】为进一步认识氧气,老师请你一起参加实验室制取氧气的实践和研究。
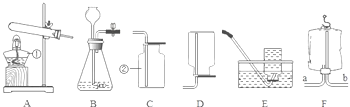
(1)实验室用A制取氧气的化学方程式为_____,收集氧气可选用E装置,理由是____.收集完气体后,测得氧气纯度明显偏低,原因可能是______(填序号).
A.高锰酸钾中混入了二氧化锰 B.收集前,集气瓶中未注满水
C.收集后,集气瓶中仍有少量水 D.未见气泡连续均匀冒出时就开始收集
(2)现准备收集氧气供铁丝、硫燃烧的实验使用,选择__(填装置序号)装置收集氧气便于直接做实验。
(3)某同学利用空塑料输液袋(如图F)收集氧气,验满氧气时,把带火星的木条放在玻璃管__(填“a”或“b”)端,若复燃则收集满了.
(4)乙炔是一种微溶于水的气体,密度与空气接近,实验室常用块状电石和水在常温下反应制取乙炔.制取乙炔的发生装置为___(填装置序号).
(5)拓展延伸:小亮同学在制取氧气的实验过程中,不小心把硫酸铜溶液滴加到了盛有5%的过氧化氢溶液中,立即产生大量气泡,于是引起了小亮同学的探究兴趣.
(提出问题)是哪种粒子能使过氧化氢分解的速率加快呢?
(查阅资料)稀硫酸中含有的粒子(H2O、H +、SO42-); CuSO4溶液主要含有三种粒子(H2O、Cu2+、SO42-),为了进一步探究CuSO4溶液中哪种粒子能起催化作用。小明同学作了以下分析和设计。
(猜想与假设)
Ⅰ、小亮同学认为不可能是H2O,理由是____;
Ⅱ、可能是SO42-;Ⅲ、可能是Cu2+.
(实验验证)
实验步骤 | 实验现象 | 结论 |
a.取一支试管加入5mL5%过氧化氢溶液,然后加入2﹣3滴稀硫酸 | 溶液几乎没有气泡放出 | ___不能使过氧化氢分解速率加快。 |
b.另取一支试管加入5mL5%过氧化氢溶液,然后加入2﹣3滴CuSO4溶液 | 溶液中有大量气泡放出 |
结论;实验证明,使过氧化氢分解速率加快的是_________。
(反思与交流)
Ⅰ、如果要证明硫酸铜是催化剂,还需要证明______。
Ⅱ、已知氧化铜也能做该反应的催化剂,现在把8克硫酸铜改为氧化铜,要使其铜元素质量相等,则需要氧化铜的质量是多少______?请列式计算。
【题目】下列说法完全正确的是
A. | 氖气的化学式 — Ne2 1个硅原子 — Si 1个钠离子 —— | B. | 决定元素种类——质子数 决定元素的化学性质——最外层电子数 决定元素周期表元素排列顺序——质子数 |
C. | 铁——由分子构成 二氧化碳——由原子构成 氯化钠——由离子构成 | D. | 分子——化学变化中的最小粒子 原子——保持物质化学性质的最小粒子 离子——带电的原子 |
A. A B. B C. C D. D