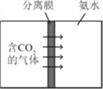
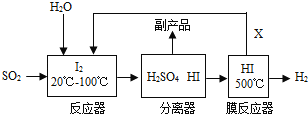
【题目】下列图像与对应的实验相符合的是
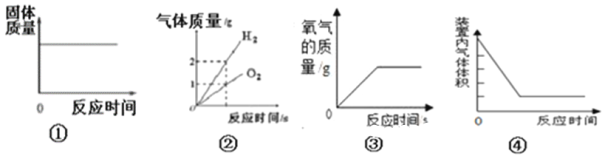
A. 图①是将一定质量的红磷放在盛有氧气的密闭容器中燃烧
B. 图②是水的电解
C. 图③是实验室用过氧化氢溶液制取氧气
D. 图④测定空气中氧气的含量时装置内气体体积
【题目】某化学兴趣小组的同学对铁还有含铁的一些物质产生了兴趣,进行了一系列探究活动,请你一同参与。
(探究一):铁丝燃烧是否需要纯氧
(实验内容):取长短相同直径均为0.38mm的铁丝,分别在O2含量不同的情况下实验。
(实验现象)
O2% | 90% | 70% | 60% | 55% |
实验现象 | 燃烧剧烈,燃烧时间长,效果好 | 燃烧比90%弱,燃烧时间短,实验成功 | 燃烧比70%弱,燃烧时间更短,实验成功 | 难以燃烧,只是发红 |
(1)在做铁丝在氧气中燃烧的实验时,最好用____法收集,该反应的符号表达式为___;
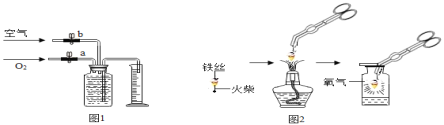
(2)若用如图1装置收集一瓶(150mL)含氧气的体积分数约为60%的气体,方法是:在150mL集气瓶里装满水,塞紧胶塞并关闭活塞b,打开活塞a通入氧气,把瓶里的水排入量筒,当量筒内的水达到设定的体积后立即关闭活塞a,然后打开活塞b通入空气,把瓶里的水全部排入量筒。则停止通入氧气时量筒内水的体积约为_______(提示:空气中氧气的体积分数约为1/5 )。
(结论):就0.38mm铁丝而言,燃烧所需氧气的最低体积分数为大于55%,且氧气浓度越大,燃烧现象越__________。(填“剧烈”或“不剧烈”);
(探究二):铁丝燃烧产生火星四射的原因
(查阅资料)
①日常生活中的钢铁制品都含有少量碳杂质。
②含碳细铁丝燃烧时,其中的炭粒生成的CO2气体在熔融液态物质中形成气泡,熔融液态物质因气泡炸裂引起“火星四射”的现象。
(实验内容)取长短相同、直径均为0.20mm、含碳量不同的铁丝分别在足量的氧气中燃烧,观察现象
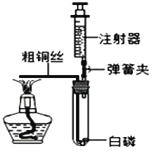
(1)小明按图2实验时,集气瓶中放水的目的是______;
(2)下表是他将几种铁丝放入氧气中燃烧时的实验现象的记录。请你分析完成下表:
物质 | 纯铁丝 | 含碳0.05%的铁丝 | 含碳0.2%的铁丝 | 含碳0.6%的铁丝 |
燃烧时 的现象 | 无火星四射现象,熔断 | 剧烈燃烧,极少火星 | 剧烈燃烧,少量火星 | _________ |
(3)通过以上实验,说明铁丝燃烧产生火星四射现象和________(填元素符号)有关。
(探究三):该化学兴趣小组还对含有铁粉的“暖宝宝”进行探究,并利用发热原理测定空气中氧气的体积分数。
(查阅资料)
“暖宝宝”中含有铁粉、活性炭、水、氯化钠等物质。遇空气发生反应的表达式是: Fe+O2+H2O→Fe(OH)2,该过程放热。

(实验回顾)
图1是实验室用红磷燃烧来粗略测定空气中氧气含量的装置。
实验原理:由于红磷燃烧消耗空气中的氧气,使瓶内______减小,量筒中水倒吸到集气瓶。若装置的气密性良好,操作规范,可以根据量筒中测出进入瓶中的水的体积,粗略测得空气中氧气的含量。
(问题提出)
有实验资料表明:燃烧过程中当氧气体积分数低于7% 时,红磷就无法继续燃烧,因此通过上述实验,测置结果与理论值误差较大。
(实验改进1)
图2是铁在空气中反应的实验装置(该装置中饱和食盐水、活性炭会加速铁在氧气中反应的速度)。兴趣小组的同学利用该装置,再次测定空气中氧气含量。
(表达与交流)
从实验原理角度分析,改进后的实验结果比前者准确度更髙的原因是_________;
(反思评价)该改进装置存在不足会影响实验结果,原因是________。
(实验改进2)
丁同学设想用图1装置,换用“暖宝宝”中的物质代替红磷将其燃烧,进行氧气含量的测定,你认为是否可行,并说明理由__________
(知识拓展)
已知某铁的氧化物中,铁元素和氧元素的质量比为7:3,则该氧化物的化学式为_____。