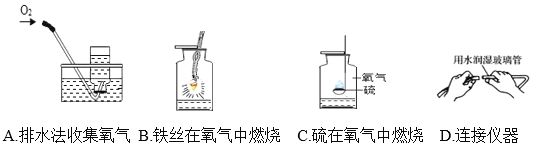
【题目】元素周期表是学习和研究化学的重要工具。请根据下表(元素周期表的部分内容)回答有关问题:
| I A | II A | IIIA | IVA | VA | VIA | VIIA | 0 |
2 | 3 Li 锂 6.941 | 4 Be 铍 9.012 | 5 B 硼 10.81 | 6 C 碳 12.01 | 7 N 氮 14.01 | 8 O 氧 16.00 | 9 F 氟 19.00 | 10 Ne 氖 20.18 |
3 | 11 Na 钠 22.99 | 12 Mg 镁 24.31 | 13 Al 铝 26.98 | 14 Si 硅 28.09 | 15 P 磷 30.97 | 16 S 硫 32.06 | 17 Cl 氯 35.45 | 18 Ar 氩 39.95 |
(1)画出16号元素的原子结构示意图_______,其阴离子符号是_____,其相对原子质量___。
(2)表中3至10号元素位于第二周期,11至18号元素位于第三周期,从原子结构示意图分析其规律可知,每一周期元素原子的_____________ 相同。
(3)表中9号和17号元素最外层电子数相同,都易________(填“得到”或“失去”)电子,则钠元素和氟元素组成的化合物的化学式为________。第11号元素与第17号元素能组成化合物,构成该物质的微粒是____(选填“分子”、“原子”或“离子”)。
(4)在元素周期表中,同一族(纵行)的元素具有相似的化学性质。则下列各组元素具有相似化学性质的是__________(填标号)。
a. C和Ne b. Be和Mg c. Al和Si d. F和Cl
【题目】为了检测石灰石样品中碳酸钙的含量,甲、乙、丙、丁四位同学分别用质量分数相同的盐酸与样品充分反应进行实验测定。已知,样品中的杂质不溶于水,且不与盐酸反应。测得数据如下表:
甲 | 乙 | 丙 | 丁 | |
所取石灰石样品质量/g | 10.0 | 10.0 | 10.0 | 10.0 |
加入盐酸的质量/g | 20.0 | 30.0 | 45.0 | 50.0 |
剩余固体的质量/g | 6.0 | 4.0 | 2.0 | 2.0 |
请回答:
⑴ 样品中碳酸钙的质量分数是_______;
⑵10.0 g样品与45.0 g盐酸充分反应后,盐酸是否还有剩余_______(填“是”或“否”);
⑶10.0 g样品与足量稀盐酸反应后可产生二氧化碳_____克?(写出计算过程,计算结果精确到0.1 g)
(可能用到的相对原子质量:H—1 C—12 O—16 Cl—35.5 Ca—40)
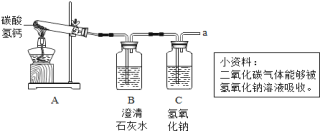
【题目】云通过探究发现,氯酸钾与氧化铜(CuO)、氧化铁(Fe2O3)混合加热,也能较快产生氧气,于是进行如下探究:
(查阅资料)氯酸钾的熔点为356℃,常温下稳定,在400℃以上则分解产生氧气。酒精灯加热温度为400℃~500℃。
(提出猜想)除MnO2、CuO外,Fe2O3也可以作氯酸钾分解的催化剂。
(完成实验)按下表进行实验并测定分解温度。
实验编号 | 实验药品 | 分解温度 |
1 | 3.0g氯酸钾 | 460℃ |
2 | 3.0g氯酸钾和0.5g二氧化锰 | 248℃ |
3 | 3.0g氯酸钾和0.5g氧化铜 | 267℃ |
4 | 3.0g氯酸钾和Xg氧化铁 | 290℃ |
(分析数据,得出结论)
(1)实验3的化学反应式:______________________。
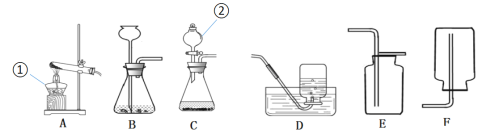
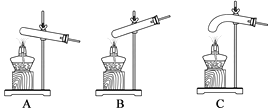
(2)小云从下图中选择该实验的最佳发生装置是__________。
(3)实验4中X的值应为__________,由实验__________与实验4对比,证明猜想合理。
(4)通过实验测得的数据,小云绘出了部分下图,请帮他完成该图。
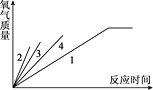
(结论)通过该实验探究中,得到的结论有__________(填序号)。
A.催化剂可降低反应温度
B.二氧化锰只能催化氯酸钾的分解
C.催化剂的质量和性质在反应前后不变
D.催化剂可改变产物的质量
E.三种催化剂中,二氧化锰对氯酸钾分解催化效果最好