【题目】化学实验室里,某化学兴趣小组发现了一瓶标签受到腐蚀的无色溶液(如图所示),他们对此产生了兴趣。
(提出问题)这瓶溶液究竟是什么?
(猜想假设)
猜想①:Na2CO3
猜想②:NaCl
猜想③:Na2SO4
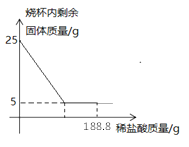
小丹同学根据标签上的信息认为一定不可能的猜想是________。
(查阅资料)Na2SO4溶液显中性
(设计实验)为了确定该溶液究意是剩余两种盐的哪一种,设计如下实验:
实验步骤 | 实验现象 | 实验结论 |
Ⅰ.取少量样品于试管中,慢慢滴加BaCl2溶液 | _______ | 猜想____成立 |
Ⅱ.向步骤Ⅰ中试管内继续加入过量稀盐酸 | 有大量气泡产生 |
(实验反思)
(1)写出实验步骤Ⅰ中发生的化学反应方程式_______________________。
(2)为达到实验目的,小丹认为上述设计实验还可简化,则下列实验操作可以是______(填序号)。
A.向样品中滴加酚酞试液看溶液的颜色变化
B.向样品中加入稀盐酸看是否有气泡产生
C.蒸发样品看是否有固体析出
【题目】合成氨是人类科学技术上的一项重大突破,对社会发展与进步做出了巨大贡献。合成氨的工艺流程图如下:
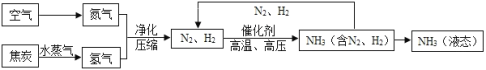
(1)流程中生成的氨(NH3),在农业上是合成_________(填“氮肥”“磷肥”或“钾肥”)的原料。
(2)制取氢气的反应过程为:C + H2O![]() CO + H2,其中发生还原反应的物质是_____________。
CO + H2,其中发生还原反应的物质是_____________。
(3)写出N2、H2反应生成NH3的化学方程式_________________________________。
(4)该流程中可循环使用的物质是___________________。
(5)将沸点不同的气体分离开来,常采用液化分离法。下表是各物质的沸点。
物质 | H2 | N2 | O2 | NH3 |
沸点 | – 252℃ | – 195.8℃ | – 183℃ | – 33.35℃ |
如控制温度t在![]() 时,可将空气中N2与O2分离。要将产物NH3与N2、H2分离开来,应将温度控制在_________(填序号)。
时,可将空气中N2与O2分离。要将产物NH3与N2、H2分离开来,应将温度控制在_________(填序号)。
A.![]() B.
B.![]() C.
C.![]()
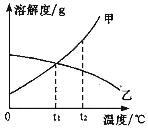
【题目】下列数据是氯化钠和氯化钾固体在不同温度时的溶解度。
温度(℃) | 0 | 20 | 40 | 60 | 80 | 100 | |
溶解度 (g) | NaCl | 35.7 | 36.0 | 36.6 | 37.3 | 38.4 | 39.2 |
KCl | 27.6 | 34.0 | 40.0 | 45.5 | 51.1 | 56.7 | |
(1)在20℃时,KCl的溶解度__(填“>”或“<”)NaCl的溶解度。
(2)20℃时,向60 g水中加入25 g氯化钠,充分溶解后,得到的溶液质量为______g。
(3)20℃时,进行了如下图所示的实验。
![]()
①A~D中,溶液中溶质的质量分数相同的是________和________(填字母)。
②下列操作能使D溶液中溶质的质量分数变小的是___________(填字母序号)。
a.加入2g KCl b.加入100g 100℃的水 c.降温至40℃
【题目】西大附中初三化学兴趣小组同学开展了下列实验:取刚降到地面的雨水水样通过pH计(测pH的仪器)每隔几分钟测一次pH,测得的结果如下表:
测定时间 | 5:05 | 5:10 | 5:15 | 5:20 | 5:25 | 5:30 |
雨水样品的pH | 4.95 | 4.94 | 4.92 | 4.88 | 4.86 | 4.85 |
(1)该雨水__________(填“是”或者“不是”)酸雨。
(2)导致正常雨水呈酸性的气体可能是__________________。
(3)在测定期间雨水的酸性逐渐__________(填“增强”或者“减弱”)。
(4)乙醇作燃料可一定程度缓解酸雨污染,请写出乙醇燃烧的方程式__________。