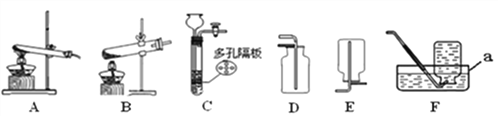
【题目】除去下列物质中混有的杂质,所用试剂和操作方法不正确的是![]()
物质 | 所含杂质 | 除杂质选用的试剂或方法 | |
A | NaCl溶液 | NaOH | 滴加适量的稀盐酸 |
B | Cu | Fe | 加入足量的稀盐酸并过滤 |
C |
| CO | 在氧气中点燃 |
D |
|
| 加入足量的水溶解并过滤、洗涤、干燥 |
A. A B. B C. C D. D
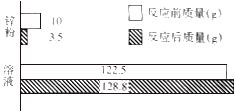
【题目】把A、B、C、D四种物质放在密闭容器中,在一定条件下充分反应,并测得反应物和产物在反应前后各物质的质量如表所示:
物质 | A | B | C | D |
反应前质量 |
|
|
|
|
反应后质量 | 待测 |
| 0 |
|
下列说法正确的是![]()
A. 物质C一定是反应物,物质D可能是单质
B. 反应后密闭容器中A的质量为![]()
C. 反应过程中,物质B和物质D变化的质量比为87:36
D. 若物质A与物质C的相对分子质量之比为194:216,则反应中A和C的化学计量数之比为2:1
【题目】同学们对制作糕点常用膨松剂Na2CO3或NaHCO3进行了下列探究。
【查阅资料】
溶解度 | 10℃ | 20℃ | 30℃ | 40℃ |
Na2CO3 | 12.5g | 21.5g | 39.7g | 49.0g |
NaHCO3 | 8.1g | 9.6g | 11.1g | 12.7g |
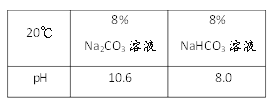
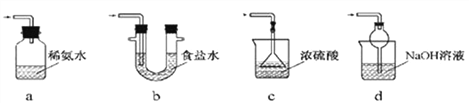
【探究一】NaHCO3和Na2CO3性质差异的探究
(1)现有20℃时溶质质量分数为8%的Na2CO3和NaHCO3溶液酸碱性:取样于试管中,分别滴加紫色石蕊试液,均显_____色;酸碱度:NaHCO3溶液________Na2CO3溶液(填“>”或”“<”)。
(2)稳定性:按下图,实验中可观察乙烧杯中的石灰水变浑浊,甲烧杯不变,则乙烧杯中发生反应的化学方程式为:___________________________。结论:在受热条件下,碳酸钠比碳酸氢钠稳定性______(填“强”或“弱”)。
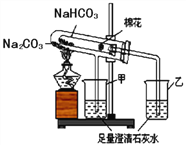
(3)利用溶解度鉴别NaHCO3和Na2CO3:分别取Xg两种固体粉末加入20℃,10g水中充分溶解,通过观察溶解现象来区分,X可以是下列的_______。(选填A、B或C)
A.1.5g B.0.96g C.0.5g
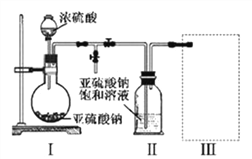
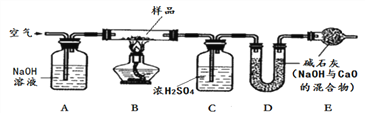
【探究二】测定NaHCO3和Na2CO3混合物10.0g中NaHCO3的质量分数(下图,夹持装置略)
【问题讨论】
(4)实验前先通一段时间的空气的目的是____________________;
(5)A的作用是_____________________________,若没有装置E,NaHCO3的质量分数测定结果会_____________(填“偏大”、“不变”或“偏小”)。
(6)停止加热后,仍继续通入空气一段时间,目的是___________________。
【含量测定】
(7)测得装置D的质量实验前为120.2g,实验后为122.4g,计算该样品中NaHCO3的质量分数。(要有计算过程)______________________
【知识拓展】
(8)向饱和的氯化钠溶液中通入氨气和二氧化碳,经过一系列变化,也可制得Na2CO3和一种铵盐。该反应的化学反应方程式为:_______________________。
【题目】氧化铜矿石含有CuO、Cu2(OH)2CO3和Fe2O3,还含有一些不溶于水、不溶于酸的其他杂质。铜、铁是畜禽所必需的微量元素,某饲料厂联合生产硫酸铜晶体和硫酸亚铁晶体的主要工艺流程如下。
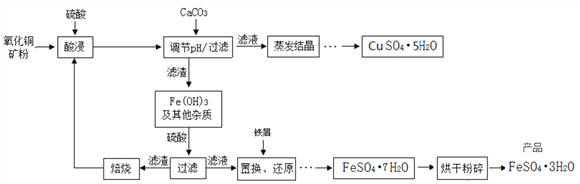
【资料】Cu2+、Fe3+以氢氧化物形式沉淀时溶液的pH见下表:
沉淀物 | Fe(OH)3 | Cu(OH)2 |
开始沉淀的pH | 1.5 | 4.2 |
沉淀完全的pH | 3.7 | 6.7 |
请回答问题:
(1)氧化铜矿石粉碎的目的是________________________________。
(2)写出“酸浸”中发生反应的化学方程式__________________(任写一个)。
(3)该流程中氢氧化铁能与硫酸反应,其基本反应类型是_________反应。
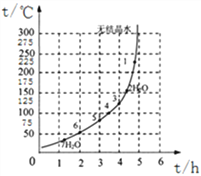
(4)下图为“硫酸亚铁干燥曲线图”,据此可确定由FeSO4·7H2O脱水得到流程中所示产品的适宜工艺条件为__________________(填写温度和时间)。
(5)在“调节pH/过滤”中,加入CaCO3调节溶液的pH,请说出溶液适宜的pH范围是____________。
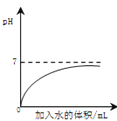
【题目】下列四个图像反映了对应实验过程中相关量的变化,其中错误的是
|
|
|
|
A.部分变质的NaOH溶液中滴加稀盐酸 | B.HCl气体的溶解度受温度影响的变化曲线 | C.等质量的Mg粉和Fe粉与足量相同浓度的稀盐酸反应 | D.硫酸溶液稀释过程中pH的变化曲线 |
A. A B. B C. C D. D