某小组想证明稀硫酸与氢氧化钠溶液反应后烧杯中的硫酸是否过量:同学们分别选取无色酚酞试液、紫色石蕊试液设计实验方案,请你判断并
实验方案 | 实验步骤 | 实验现象 | 实验结论 |
方案一 | 取样,滴入无色酚酞试液 | 溶液不变色 | 稀硫酸过量 |
方案二 | 取样,滴入几滴紫色石蕊溶液 | 溶液变红 | 稀硫酸过量 |
上述设计的实验方案中,正确的是______(填“方案一”或“方案二”)另外一个实验方案错误的原因是______;写出硫酸与氢氧化钠溶液发生反应的化学方程式______。
(实验延伸)请你再设计一个确定稀硫酸是否过量的实验方案,你选用的药品是______,实验现象及结论是______。
某化学兴趣小组同学了解氯气(Cl2)是黄绿色气体,它的水溶液叫氯水。当同学们把紫色石蕊溶液加到氯水中,发现溶液先变红,后褪色。
(查阅资料)
(1)氯气溶于水,部分以C12分子存在于溶液中,部分与水反应C12+H2O=HCl+HClO。
(2)次氯酸(HCl)是一种弱酸,具有强氧化性,见光易分解。其反应方程式为:2HClO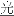 2HCl+O2↑
2HCl+O2↑
(现象分析)使紫色石蕊溶液变红的物质是氯水中的盐酸和______。
(提出问题)使紫色石蕊溶液褪色的物质是什么呢?
(提出猜想)
猜想1:氯水中的水使紫色石蕊褪色;
猜想2:氯水中的______使紫色石蕊褪色;
猜想3:氯水中的盐酸使紫色石蕊褪色;
猜想4:氯水中的次氯酸使紫色石蕊褪色。
(实验探究)取四朵用石蕊溶液染成紫色的干燥的纸花进行以下实验。
实验操作 | 实现现象 | 实验结论 |
①第一朵纸花喷水 | ①没有明显变化 | 猜想1 ______ |
②第二朵纸花直接放入盛有干燥的 ______ 集气瓶 | ②没有明显变化 | 猜想2不成立 |
第三朵纸花喷上稀盐酸 | ③变红,但 ______ | 猜想3不成立 |
④第四朵纸花喷上水后, ______ | ④先变红,后褪色 | 猜想4 ______ |
(拓展探究)实验室中保存氯水的方法是______。
(反思与评论)
兴趣小组同学想继续探究盐酸中的哪一种粒子使紫色石蕊溶液变红,设计如下实验方案:取少量盐酸于试管中,滴入几滴紫色石蕊溶液,再用滴管慢慢滴加氢氧化钠溶液,并不断搅拌,至红色消失。说明水分子和______(填化学符号)不能使石蕊变红。
请你设计其他实验方案探究验证:
实验操作 | 实验现象 | 实验结论 |
______ | ______ | ______ |



