0 111304 111312 111318 111322 111328 111330 111334 111340 111342 111348 111354 111358 111360 111364 111370 111372 111378 111382 111384 111388 111390 111394 111396 111398 111399 111400 111402 111403 111404 111406 111408 111412 111414 111418 111420 111424 111430 111432 111438 111442 111444 111448 111454 111460 111462 111468 111472 111474 111480 111484 111490 111498 211419




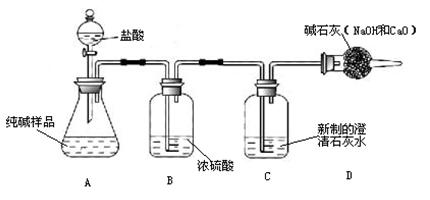
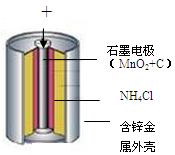

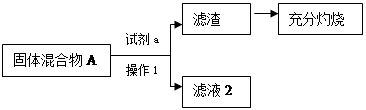
 (1)小王同学认为试剂a为水,你认为能不能实现实验目的?答: 。
(1)小王同学认为试剂a为水,你认为能不能实现实验目的?答: 。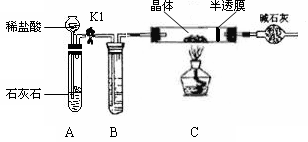
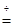 ZnSO4 + xH2O),冷却至常温后,称量玻璃管中固体其质量为16.1g。
ZnSO4 + xH2O),冷却至常温后,称量玻璃管中固体其质量为16.1g。