已知:常温下二氧化硫是无色气体,它能与水反应生成亚硫酸
( ),亚硫酸的酸性比碳酸的酸性要强.为了验证二氧化硫能与水发生反应,请你共同来研究.
),亚硫酸的酸性比碳酸的酸性要强.为了验证二氧化硫能与水发生反应,请你共同来研究.
(1)
要验证二氧化硫气体能与水反应,你认为最好用下述中的_______(填选项编号)方法来证明.[
]|
A .讨论 |
B .调查 |
C .实验 |
(2)
甲同学用图所示的方法,将二氧化硫气体通入到紫色石蕊试液中,观察溶液颜色的变化.他得出:紫色石蕊试液会变______色,证明二氧化硫能与水反应.
(3)
乙同学用紫色石蕊试液将白色滤纸染咸紫色,干燥后扎成了四只紫色蝴蝶,然后分别进行如下实验:①一只喷洒稀酸;②一只喷水;③一只直接放入盛有二氧化硫气体的集气瓶中;④一只喷洒水后放入盛有二氧化硫的集气瓶中.
在乙同学的实验中,紫色小蝴蝶不会变色的是
________、________(填实验编号).(4)
你觉得甲、乙同学的方案相比,哪个更好?______,你的理由:_______.(5)
你还有其他方案吗?如有,说出你的一种方案.操作:_______.现象结论;_______.实验室里有一瓶标签残缺的盐酸,请你来共同探究.
(1)怎样立即确定它是不是浓盐酸?有人猜测是,有人记得好像不是,大家各抒己见.你认为应该用下述中的____________(填选项编号)方法立即确认.[
]|
A .讨论 |
B ,调查 |
|
C .实验 |
D .上网 |
(2)
粗略测定该盐酸每毫升溶液中含溶质HCl的质量.同学们依据酸和碱中和反应的原理,设计了一种可行的实验方案,其操作步骤如下:第
1步,在小烧杯中滴加10g5%的NaOH溶液;第
2步,向上述烧杯中滴入2滴酚酞试液;第
3步,向10mL的量筒里注入该盐酸至一定刻度;第
4步,用胶头滴管吸取量筒中的盐酸,逐滴滴入上述烧杯中,……一直滴到溶液由红色刚刚变为无色为止;第
5步,记录实验数据;第
6步,计算,确定每毫升盐酸中含有溶质HCl的质量.请根据以上实验过程,回答下列问题:①本实验为什么要用指示剂
(酚酞)?_________________________.②第
3步中向量筒中注入盐酸,量筒中液面的位置如图所示,A与B、B与C刻度均相差1mL,如果刻度A为8,量筒中盐酸的体积是_____mL.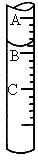
③第
4步要用玻璃棒,它的作用是_______,目的是__________.停止滴入盐酸后,胶头滴管中残留的盐酸应________________.④第
5步要记录的实验数据是___________________________.(3)
测定每毫升该盐酸中含溶质HCl的质量,有人提出用KOH等碱类试剂代替上述NaOH溶液与盐酸进行中和反应,测定耗去的盐酸的体积,通过计算确定盐酸中HCl的含量,这和上述实验属于同一种方法;你能写出其他可行的方法吗?若能,请写在下面(用文字简述所依据的原理和要测定的数据,不需要写出化学方程式).___________________________________________

 .如何配制50g溶质质量分数为5%的盐酸溶液?
.如何配制50g溶质质量分数为5%的盐酸溶液?