题目内容
现有HCl与CaCl2的混合溶液,为了分析混合溶液中HCl和CaCl2的质量分数,设计了如下实验方案:

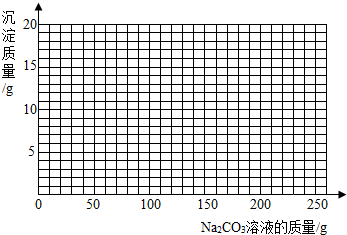
[实验数据]实验共记录了两组数据:第①组,气体吸收完全后,NaOH溶液质量增加4.4g;第②组,沉淀完全后,经过滤、洗涤、烘干后得到固体的质量为10g.
根据实验设计及有关数据进行分析与计算:
(1)混合溶液中HCl的质量分数为
(2)混合溶液中CaCl2的质量分数为多少?(写出计算过程)

[实验数据]实验共记录了两组数据:第①组,气体吸收完全后,NaOH溶液质量增加4.4g;第②组,沉淀完全后,经过滤、洗涤、烘干后得到固体的质量为10g.
根据实验设计及有关数据进行分析与计算:
(1)混合溶液中HCl的质量分数为
7.3%
7.3%
.(只写结果)(2)混合溶液中CaCl2的质量分数为多少?(写出计算过程)
分析:(1)由题意可以知道生成二氧化碳的质量为4.4g,据此结合碳酸钠和盐酸反应的化学方程式求算出氯化氢的质量,然后求出其质量分数即可;
(2)根据图中数据可以知道生成沉淀的质量为10g,据此结合碳酸钠和氯化钙反应的化学方程式求算出氯化钙的质量,然后求出其质量分数即可.
(2)根据图中数据可以知道生成沉淀的质量为10g,据此结合碳酸钠和氯化钙反应的化学方程式求算出氯化钙的质量,然后求出其质量分数即可.
解答:解:(1)氢氧化钠溶液增加的质量即为碳酸钠和盐酸反应生成二氧化碳的质量,即为4.4g,
设混合溶液中含有氯化氢的质量为x
Na2CO3+2HCl═2NaCl+H2O+CO2↑
73 44
x 4.4g
=
x=7.3g
∴混合溶液中HCl的质量分数为:
×100%=7.3%;
故答案为:7.3%;
(2)设混合溶液中CaCl2的质量为m
CaCl2+Na2CO3═CaCO3↓+2NaCl
111 100
m 10g
=
m=11.1g
∴混合溶液中CaCl2的质量分数为:
×100%=11.1%;
答:混合溶液中CaCl2的质量分数为11.1%.
设混合溶液中含有氯化氢的质量为x
Na2CO3+2HCl═2NaCl+H2O+CO2↑
73 44
x 4.4g
| 73 |
| x |
| 44 |
| 4.4g |
x=7.3g
∴混合溶液中HCl的质量分数为:
| 7.3g |
| 100g |
故答案为:7.3%;
(2)设混合溶液中CaCl2的质量为m
CaCl2+Na2CO3═CaCO3↓+2NaCl
111 100
m 10g
| 111 |
| m |
| 100 |
| 10g |
m=11.1g
∴混合溶液中CaCl2的质量分数为:
| 11.1g |
| 100g |
答:混合溶液中CaCl2的质量分数为11.1%.
点评:要解答好这类题目,首先,要理解和熟记根据化学反应方程式的计算步骤和格式,以及与之相关的知识等.然后,根据所给的问题情景,结合反应流程,物质间反应的方程式,按照题目要求进行认真地解答即可.

练习册系列答案
相关题目
 12、常温下,有些盐如CaCl2、NaCl等物质的水溶液呈中性;有些盐如Na2CO3等物质的水溶液呈碱性;有些盐如NH4Cl等物质的水溶液呈酸性.现有HCl与CaCl2的混合溶液,向其中逐滴加入过量某物质X,溶液的pH随滴入X的量的变化关系如图所示.则X是( )
12、常温下,有些盐如CaCl2、NaCl等物质的水溶液呈中性;有些盐如Na2CO3等物质的水溶液呈碱性;有些盐如NH4Cl等物质的水溶液呈酸性.现有HCl与CaCl2的混合溶液,向其中逐滴加入过量某物质X,溶液的pH随滴入X的量的变化关系如图所示.则X是( )