题目内容
【题目】纯碱样品中含有少量的氯化钠,某同学为测定其成分,他取一定质量的该纯碱样品于试管中,加入一定量的稀盐酸,恰好完全反应,放出4.4g气体,得到84.5g含溶质为17g的食盐溶液。请计算:
(1)原混合物中碳酸钠的质量_____;
(2)所加稀盐酸中溶质的质量分数_____。
【答案】10.6g 10%
【解析】
根据生成的二氧化碳的质量和对应的化学方程式求算碳酸钠和HCl的质量以及生成的氯化钠的质量,进而进行其他相关计算。
设参加反应的碳酸钠的质量为x,生成的氯化钠的质量为y,消耗的HCl的质量为z

![]()
x=10.6g
y=11.7g
z=7.3g
则原化合物中氯化钠的质量为17g﹣11.7g=5.3g
则盐酸的质量为84.5g+4.4g﹣5.3g﹣10.6g=73g
所加稀盐酸中溶质的质量分数为![]() ×100%=10%
×100%=10%
答:(1)原混合物中碳酸钠的质量为10.6g;(2)所加稀盐酸中溶质的质量分数为10%。

 阅读快车系列答案
阅读快车系列答案【题目】化学是在分子、原子水平上研究物质的组成、结构、性质及其变化规津的一门基础自然科学,回答下列问题:
(1)在二氧化碳、铁和氢氧化钠三种物质中,氢氧化钠由_____构成;(写具体粒子的名称)。
(2)下表列出了部分元素的原子结构示意图。回答下列问题:
O | Mg | S | Cl |
|
|
|
|
硫原子在化学反应中容易_____(填“得到”或“失去”)电子,氧元素和硫元素化学性质具有相似性的原因是它们原子的_____相同。
(3)下列对生活中的现象用分子相关知识解释不正确的是_____。
A室内插花,满室飘香,说明分子不断地运动
B水沸腾时,掀起壶盖,说明分子的大小随温度升高而增大
C10mL酒精和l0mL水混合后,体积小于20mL,说明分子之间有间隔
D湿衣服放在火炉旁,干得较快,说明分子运动速率随温度升高而增大
(4)在化学变化前后一定发生改变的是_____(填字母)。
A元素的种类 B原子的个数 C原子的质量 D分子的种类
(5)氟元素和氢元素形成的化合物的水溶液叫氢氟酸(HF),可用于雕刻玻璃,其主要原因是氢氟酸和玻璃的主要成分二氧化硅发生反应,生成四氟化硅气体和水,写出该反应的化学方程式_____。
【题目】甲、乙、丙三种物质间通过一步反应能实现如图转化,下列选项符合图示转化关系的是( )
选项 | 甲 | 乙 | 丙 |
A | C | CO2 | CO |
B | CaCO3 | Ca(OH)2 | CaCl2 |
C | MgO | H2O | O2 |
D | NaCl | NaNO3 | NaOH |
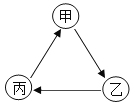
A.AB.BC.CD.D