题目内容
11.将盛有稀硫酸的烧杯放在天平的左盘上称量,先后加上砝码100g,20g,5g,又将游码移至0.8g处,已知其中稀硫酸为50g,投入锌片10g,当反应完全,没有气泡生成时,再称其总质量为135.6g,试计算:(1)生成氢气的质量为多少?
(2)稀硫酸中硫酸的质量分数是多少?
(3)反应后溶液中溶质质量分数是多少?
分析 锌与硫酸反应生成硫酸锌和氢气;根据质量守恒定律,利用锌的质量,根据反应的化学方程式列式计算出生成氢气的质量、以及硫酸的质量和生成硫酸锌的质量,进而求出稀硫酸的溶质质量分数以及生成物溶液的溶质质量分数进行解答.
解答 解:(1)生成氢气的质量:(100 g+20 g+5 g+0.8 g+10 g)-135.6 g=0.2 g
(2)设参加反应的锌的质量为x,硫酸质量为y,反应生成硫酸锌质量为z
Zn+H2SO4═ZnSO4+H2
65 98 161 2
x y z 0.2 g
$\frac{65}{x}=\frac{98}{y}=\frac{161}{z}=\frac{2}{0.2g}$
x=$\frac{65×0.2g}{2}$=6.5 g
y=$\frac{98×0.2g}{2}$=9.8 g
z=$\frac{161×0.2g}{2}$=16.1 g
稀硫酸中硫酸的质量分数是:$\frac{9.8g}{50g}$×100%=19.6%
反应后溶液中溶质质量分数是:$\frac{161.1g}{50g+6.5g-0.2g}$×100%=28.6%
答案:(1)生成氢气的质量为0.2 g; (2)稀硫酸中硫酸的质量分数是19.6%; (3)反应后溶液中溶质质量分数是28.6%.
点评 本题难度不大,掌握根据化学方程式的计算即可正确解答本题.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
1.下列保护自然资源的认识中,错误的是( )
| A. | 寻找金属替代品有利于保护金属资源 | |
| B. | 植树造林有利于保护空气资源 | |
| C. | 禁止废水任意排放有利于保护水资源 | |
| D. | 用乙醇汽油代替汽油能抑制温室效应 |
19.下列物质中,含有氧分子的是( )
| A. | O 2 | B. | H 2O | C. | CO 2 | D. | SO 2 |
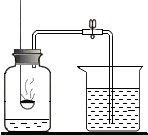 用燃烧红磷(红磷过量)的方法测定空气中氧气的含量,如图所示,当火焰熄灭后,打开弹簧夹,烧杯中的水流入集气瓶中,约占总体积的$\frac{1}{5}$,剩余气体主要是氮气.根据观察的现象推测,氮气具有哪些性质?
用燃烧红磷(红磷过量)的方法测定空气中氧气的含量,如图所示,当火焰熄灭后,打开弹簧夹,烧杯中的水流入集气瓶中,约占总体积的$\frac{1}{5}$,剩余气体主要是氮气.根据观察的现象推测,氮气具有哪些性质?