题目内容
10.某用海水晒制得到的粗盐中常含有少量的CaCl2、MgCl2和泥沙.小文同学设计如下流程对其提纯:
请回答下列问题:
(1)写出有关操作的名称:操作1过滤,操作3蒸发;
(2)在“溶液1”中加入过量的NaOH溶液的目的是除去MgCl2;
(3)写出“悬浊液2”与碳酸钠溶液反应的化学方程式:CaCl2+Na2CO3=2NaCl+CaCO3↓;
(4)流程中的“x溶液”是指稀盐酸;
(5)在操作无误的情况下发现最终得到的氯化钠固体的质量大于原粗盐的质量,其原因是提纯过程中有氯化钠生成.
分析 (1)根据过滤可用于分离可溶性固体和难溶性固体进行分析;
根据蒸发操作可以使固体从溶液中析出进行分析;
(2)根据氢氧化钠和氯化镁会生成氢氧化镁沉淀进行分析;
(3)根据碳酸钠和氯化钙反应生成碳酸钙沉淀和氯化钠进行分析;
(4)根据前面除杂加入的氢氧化钠、碳酸钠都是过量的,对于氯化钠来说也是杂质进行分析;
(5)根据碳酸钠、氢氧化钠除杂,以及和盐酸反应都生成了氯化钠进行分析.
解答 解:(1)过滤可用于分离可溶性固体和难溶性固体,蒸发操作可以使固体从溶液中析出,所以:操作1过量,操作3蒸发;
(2)氢氧化钠和氯化镁会生成氢氧化镁沉淀,所以在“溶液1”中加入过量的NaOH溶液的目的是除去氯化镁;
(3)碳酸钠和氯化钙反应生成碳酸钙沉淀和氯化钠,化学方程式为:CaCl2+Na2CO3=2NaCl+CaCO3↓;
(4)前面除杂加入的氢氧化钠、碳酸钠都是过量的,对于氯化钠来说也是杂质,需要加入盐酸除去,所以流程中的“x溶液”是指稀盐酸;
(5)碳酸钠、氢氧化钠除杂,以及和盐酸反应都生成了氯化钠,所以在操作无误的情况下发现最终得到的氯化钠固体的质量大于原粗盐的质量.
故答案为:(1)过滤,蒸发;
(2)除去MgCl2;
(3)CaCl2+Na2CO3=2NaCl+CaCO3↓;
(4)稀盐酸;
(5)提纯过程中有氯化钠生成.
点评 本题从多个角度对氯化钠的提纯实验进行了全面考察,灵活性强,需要在平时多加训练.

练习册系列答案
相关题目
20.下列气体不能用浓硫酸干燥的是( )
| A. | NH3 | B. | H2 | C. | CO2 | D. | O2 |
15.下列说法正确的是( )
| A. | 用水无法区分硝酸铵、氯化钠、氢氧化钠三种固体 | |
| B. | 铅锑合金熔点高,用来制作保险丝 | |
| C. | 组装观察水的沸腾的实验装置时,应按照先上后下的顺序来组装 | |
| D. | 某化肥与碱混合研磨,产生刺激性气味的气体,证明该化肥是铵态氮肥 |
2.以下是小明同学书写的部分化学用语,其中正确的是
①金刚石-C ②五氧化二磷-O5P2 ③氯化铁-FeCl2 ④钠元素显+1价-Na+1
⑤两个铝离子-2Al3+( )
①金刚石-C ②五氧化二磷-O5P2 ③氯化铁-FeCl2 ④钠元素显+1价-Na+1
⑤两个铝离子-2Al3+( )
| A. | ①②④ | B. | ①⑤ | C. | ②③⑤ | D. | ②③④ |
19.类比推理是化学学习中的一种重要思维方式,以下类推结果正确的是( )
| A. | 室温下,pH值<7的溶液显酸性,所以pH值<7的雨水是酸雨 | |
| B. | 中和反应生成盐和水,所以生成盐和水的反应一定是中和反应 | |
| C. | 分子、原子可以构成物质,所以物质一定是由分子、原子构成的 | |
| D. | 溶液具有均一性,所以上层溶液跟下层溶液浓度一样 |

 .
.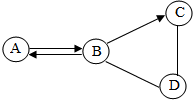 A、B、C、D为初中化学常见四种不同类别的化合物,它们之间有如图所示的转化和反应关系“→”表示某一种物质经一步反应可转化为另一种物质,“-”表示相连两种物质能发生化学反应,部分反应物、生成物及反应条件已略去).C在生活中可用来除油污,且C的固体可作某些气体的干燥剂,则C俗名是烧碱;A的用途为灭火;写出B→C转化的化学方程式:Na2CO3+Ca(OH)2=CaCO3↓+2NaOH.
A、B、C、D为初中化学常见四种不同类别的化合物,它们之间有如图所示的转化和反应关系“→”表示某一种物质经一步反应可转化为另一种物质,“-”表示相连两种物质能发生化学反应,部分反应物、生成物及反应条件已略去).C在生活中可用来除油污,且C的固体可作某些气体的干燥剂,则C俗名是烧碱;A的用途为灭火;写出B→C转化的化学方程式:Na2CO3+Ca(OH)2=CaCO3↓+2NaOH.