题目内容
【题目】空气是一种重要资源,空气质量成为人们日益关注的话题。

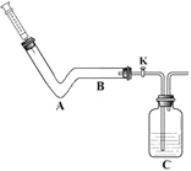
(1)利用如图装置可以测定空气中氧气的含量。实验测得空气
中氧气的体积分数为18.2%,请分析该实验出现误差的原因:
。(写一点)
(2)某工业城市空气中二氧化碳含量偏高,其原因可能是 。为了减缓二氧化碳使全球变暖的趋势,有科学家提出大胆设想:将二氧化碳压缩使其液化,然后将其压入到冰冷的深海中。但也有科学家担心海水中富含二氧化碳后酸度会增加,可能会杀死一些海洋生物,产生其他环境问题等。二氧化碳在深海中的溶解度和在通常状况下的水中的溶解度相比较,是 (填“较大”、“相等”或“较小”)。
(3)经测定该城市某次降雨的pH约为5,该次降雨 (填“是”或“不是”)酸雨,造成该城市空气污染的有害气体主要是 (写一种气体即可)。
(4)空气污染的一个主要来源是汽车的尾气排放。现用纳米级的某种氧化物做催化剂,使汽车尾气中的两种有毒气体CO和NO反应转化为两种无毒气体,其中一种是空气中含量最高的气体。生成的这两种气体是 和 。
【答案】(1)铜丝不足。(合理均可)
(2)大量使用化石燃料(合理均可) 较大
(3)是 SO2或NO2
(4)CO2 N2
【解析】
试题分析:(1)铜和氧气反应生成氧化铜,根据质量守恒定律知道,反应前后的原子种类和个数都不变,铜丝的量的多少决定了对氧气的消耗量,所以在实验时要保证铜丝过量,实验测得空气中氧气的含量为18.2%<21%,造成该实验出现误差的原因可能是铜丝的量不足;
(2)工业城市中要燃烧大量的化石燃烧煤炭,煤炭燃烧生成大量的二氧化碳和二氧化硫;气体的溶解度和压强有关,压强越大,气体的溶解度越大;
PH<5.6的属酸雨,现降雨的pH约为5属酸雨;造成酸雨的主要气体是二氧化硫;
空气中含量最高的气体是氮气,依据质量守恒定律化学反应前后元素的种类不变可知另一种气体是二氧化碳。

【题目】(7分)下图是实验探究氢气与氧气混合点燃发生爆炸的条件:

⑴乙装置中对试管加热的仪器名称是 ;在实验室中利用氯酸钾和二氧化锰制取氧气,反应的化学方程式是 ;利用锌粒和稀硫酸制取氢气,可以利用下列
(选填“甲”或“乙”)作为发生装置。
⑵利用丙装置可将氢气、氧气收集并混合起来。某次实验的操作过程如下:先将瓶子装满水,打开a、b,从右边导管通入氢气至水面降至400mL,水从左边导管流出(如图),然后继续从右边导管通入氧气至液面降到100mL,关闭b。此时瓶中收集到的混合气体中氢气与氧气的体积比为 。打开b,再从左边导管向瓶中加水,使混合气体全部排出,并用一次性保鲜袋收集,直接点燃保鲜袋内的混合气体。实验共四次,实验数据及现象记录如下表,请将表中漏填的数据及现象补填上。
实验次数 | 第一次 | 第二次 | 第三次 | 第四次 |
氢气与氧气的体积比 | 1︰4 | 2︰3 | 2︰1 | 4︰1 |
氢气的体积百分数 | 20% | 40% | % | 80% |
点燃后现象 | 爆炸 |
| 爆炸 | 保鲜袋燃烧,没有爆炸 |
由此可见氢气与氧气混合发生爆炸,除要达到燃烧的三个条件外,还和氢气的体积分数有关。