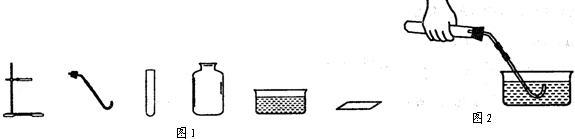
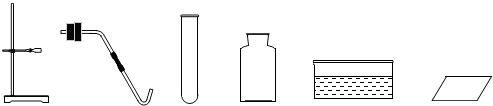
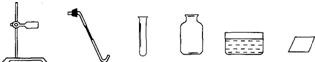题目内容
实验室用分解高锰酸钾的方法制取氧气.(1)用高锰酸钾制取氧气的化学方程式是
(2)现有如图所示的仪器,要制备并收集氧气,还需要补充的一种仪器是
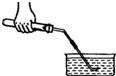
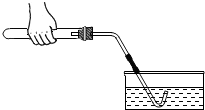
(3)实验开始前如图所示检查装置气密性,检查气密性的方法是
(4)分解过氧化氢溶液也可制得氧气.34g过氧化氢中氧元素的质量m1=
请回答,根据质量守恒定律,m1-m2表示的是
分析:(1)熟记常用的化学方程式.
(2)要会选择合适的仪器并能熟练组装一些常用的实验装置.
(3)根据气体压强的知识进行分析.
(4)过氧化氢中氧元素的质量=过氧化氢的质量×过氧化氢中氧元素的质量分数;利用过氧化氢制氧气的化学方程式,根据过氧化氢的质量求出氧气的质量;根据质量守恒定律,化学反应前后元素的质量不变来求.
(2)要会选择合适的仪器并能熟练组装一些常用的实验装置.
(3)根据气体压强的知识进行分析.
(4)过氧化氢中氧元素的质量=过氧化氢的质量×过氧化氢中氧元素的质量分数;利用过氧化氢制氧气的化学方程式,根据过氧化氢的质量求出氧气的质量;根据质量守恒定律,化学反应前后元素的质量不变来求.
解答:解:
(1)高锰酸钾加热生成锰酸钾、二氧化锰和氧气.
(2)用加热高锰酸钾的方法制氧气时,反应物的状态是固态,反应条件是加热,应选用固-固加热型的发生装置,应用的仪器有:试管、铁架台、合适的橡皮塞带导气管、酒精灯;根据所提供的仪器可知是用排水法收集氧气,应用的仪器有:水槽、集气瓶、玻璃片.
(3)把导管的一端浸入水中,两手紧握试管外壁,试管内的空气会受热膨胀,气体压强增大,会看到导管口有气泡冒出,手松开后,试管内的温度降低,气体遇冷收缩,气体压强减小,在外界大气压的作用下,水被压入导管,会看到导管口出现一段水柱.
(4)34g过氧化氢中氧元素的质量m1=34g×
=32g
2H2O2
2H2O+O2↑
68 32
34g m2
=
,m2=16g
根据化学方程式可看出过氧化氢中氧元素的质量=水中氧元素的质量+氧气的质量,所以m1-m2表示的是水中氧元素的质量.
故答案为:(1)2KMnO4
K2MnO4+MnO2+O2↑
(2)酒精灯
(3)把导管的一端浸入水中,两手紧握试管外壁,若导管口有气泡冒出,手松开后导管口出现一段水注
(4)32;16;水中氧元素的质量
(1)高锰酸钾加热生成锰酸钾、二氧化锰和氧气.
(2)用加热高锰酸钾的方法制氧气时,反应物的状态是固态,反应条件是加热,应选用固-固加热型的发生装置,应用的仪器有:试管、铁架台、合适的橡皮塞带导气管、酒精灯;根据所提供的仪器可知是用排水法收集氧气,应用的仪器有:水槽、集气瓶、玻璃片.
(3)把导管的一端浸入水中,两手紧握试管外壁,试管内的空气会受热膨胀,气体压强增大,会看到导管口有气泡冒出,手松开后,试管内的温度降低,气体遇冷收缩,气体压强减小,在外界大气压的作用下,水被压入导管,会看到导管口出现一段水柱.
(4)34g过氧化氢中氧元素的质量m1=34g×
| 32 |
| 34 |
2H2O2
| ||
68 32
34g m2
| 68 |
| 34g |
| 32 |
| m2 |
根据化学方程式可看出过氧化氢中氧元素的质量=水中氧元素的质量+氧气的质量,所以m1-m2表示的是水中氧元素的质量.
故答案为:(1)2KMnO4
| ||
(2)酒精灯
(3)把导管的一端浸入水中,两手紧握试管外壁,若导管口有气泡冒出,手松开后导管口出现一段水注
(4)32;16;水中氧元素的质量
点评:检查装置的气密性时要先把导管的一端浸入水中,然后两手紧握试管外壁,若这两步操作颠倒,先用两手紧握试管外壁,试管中的空气已受热排出装置外,再把导管的一段浸入水中,这时不管装置漏气不漏气,都不会看到有气泡冒出.

练习册系列答案
相关题目