题目内容
【题目】钛和钛合金因具有强度高、耐腐蚀性好、耐热性高等特点而被广泛用于各个领域。以钛铁矿(主要成分为FeTiO3)为原料制备金属钛的工艺流程如图所示:

(1)步骤②中根据TiCl4、FeCl3的_______________不同进行蒸馏分离;
(2)步骤③中氩气不是催化剂,则反应中氩气的作用是_______________;写出该步骤中反应的化学方程式_____________。
(3)整个工艺流程中可以循环使用的物质有____________。
【答案】沸点 作保护气,防止生成的钛在高温下被氧化  Mg、Cl2(或镁、氯气)
Mg、Cl2(或镁、氯气)
【解析】
(1)蒸馏是利用混合物中各成分的沸点不同,在加热时可以先后挥发,将其分离的一种操作,流程中根据TiCl4、FeCl3的沸点不同将其进行蒸馏分离;
(2)步骤③中氩气不是催化剂,由于氩气的化学性质稳定,故反应中氩气的作用是作保护气,防止生成的钛在高温下被氧化;步骤③中反应物是Mg与TiCl4 ,生成物是MgCl2与Ti,反应条件是高温,则反应的化学方程式为![]() ;
;
(3)整个工艺流程中, Mg、Cl2既是反应物,又是生成物,均可循环使用。

练习册系列答案
相关题目
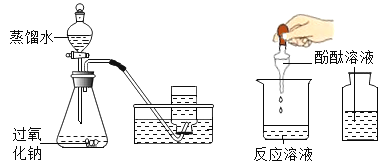
【题目】为测定某化工厂废水中硫酸的溶质质量分数。同学们做了如下实验(废水中的其他成分不与铁发生反应)。

(1)反应共生成氢气____________g。
(2)废水中硫酸的溶质质量分数是多少?______
【题目】如表列出了部分元素原子结构示意图。下列叙述错误的是( )
Na | Al | Si | P | S | Cl | Ar | |
|
|
|
|
|
|
|
|
A. 在显电性的情况下,表中m的值为8
B. 如果失去第三层电子,上表空格内的微粒符号可表示为Mg+2
C. 上表中所列元素属于同一周期的原因是原子核外的电子层数相同
D. 钠原子在化学反应中易失电子