题目内容
3.NaClO2广泛用于造纸工业,NaClO2中氯元素的化合价为( )| A. | -1 | B. | 0 | C. | +3 | D. | +5 |
分析 根据在化合物中正负化合价代数和为零进行解答.
解答 解:根据在化合物中正负化合价代数和为零,钠元素的化合价为+1,氧元素的化合价为-2,设亚氯酸钠(NaClO2)中氯元素的化合价为x,则:(+1)+x+(-2)×2=0,解答x=+3.
故选C.
点评 本题考查学生根据在化合物中正负化合价代数和为零计算指定元素化合价的解题能力.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
13.关于双氧水制氧气的说法正确的是( )
| A. | 溶液中的质量不变 | B. | 只有加入二氧化锰才能制得氧气 | ||
| C. | 液体中氢元素质量分数变大 | D. | 氧元素全部由化合态变为游离态 |
14.在2A+B═2C反应中,已知A的相对分子质量是28,C的相对分子质量是44,则B的相对分子质量是( )
| A. | 16g | B. | 16 | C. | 32g | D. | 32 |
18.下列物质属于化合物的是( )
| A. | 硫 | B. | 水 | C. | 铜 | D. | 空气 |
8.阿司匹林的分子式为C9H8O4,下列关于阿司匹林的说法正确的是( )
| A. | H、O原子个数比为1:8 | B. | 相对分子质量为180 | ||
| C. | 阿司匹林中含21种元素 | D. | 氧元素的质量分数最小 |
19.海水晒盐就是利用涨潮将海水引入贮水池,再引入蒸发池,接着到结晶池,这样不断地风吹日晒,海水就慢慢成为食盐的饱和溶液,晶体就会逐渐析出,得到粗盐.基础实验6“粗盐的初步提纯”是同学们在初中阶段化学学习必须完成的实验活动之一.
请回答下列问题:

【实验过程】
(1)称量与溶解
①调节托盘天平(如图甲):使游码回零,若天平指针偏向左边,可将左边螺母向右(填“左”或“右”)旋动,使指针摆动达到平衡.
②用托盘天平称取粗盐的质量为2g(只用到游码,平衡时游码位置如图乙):再用量筒称取10mL蒸馏水,将粗盐和蒸馏水转移到烧杯中,用玻璃棒搅拌,使粗盐充分溶解.
(2)过滤
③制作过滤器,并进行过滤操作,然后仔细观察过滤纸上的剩余物质及滤液的颜色.
④一开始时,乐乐小组同学的过滤操作(如图丙).
请将其中的错误之处加以指正:没有玻璃棒引流.
⑤老师发现红红同学过滤的速度明显比其它的小组要慢,分析其中可能的原因是:滤纸和漏斗壁之间有气泡.
(3)蒸发
将过滤后所得的溶液转移后进行蒸发(如图丁),待出现较多固体时,停止加热,利用余热将滤液蒸干.
⑥盛装滤液的仪器甲的名称是蒸发皿.
⑦玻璃棒所起的作用是使液体均匀受热,防止局部温度过高,造成液滴飞溅.
(4)计算产率
蒸发操作结束后,用玻璃棒将固体转移到纸片上,比较食盐提纯前后的状态,称量提纯后的食盐(精盐)的质量为1.7g.最后将固体回收到指定的容器中.
⑧精盐产率(%)的计算过程和结果=85%.
【拓展提升】
(5)物质溶解情况可以定量表示,现提供氯化钠和硝酸钾的溶解度数据如表所示.
⑨在图戊中,请你一定要多加小心先来描点,然后绘制硝酸钾的溶解度曲线图.
⑩在化学上,分离物质有多种方法.欲使某温度下的硝酸钾饱和溶液中的硝酸钾析出,你认为可能的方法有冷却热饱和溶液(降温结晶),若从硝酸钾和氯化钠(少量)的混合物中分离出硝酸钾,你的实验方案是:先制成高温下的硝酸钾饱和溶液,再冷却,过滤.
(6)“粗盐的初步提纯”实验中得到的精盐并不是纯净物,还含有少量可溶性的杂质.若要除去其中含有的Mg2+、Ca2+、和硫酸根,依次加入下列试剂(每一步都过量)并采取相应的实验操作手段,能够达到实验目的是:BD.
A.BaCl2、NaOH、Na2CO3、H2SO4
B,BaCl2、NaOH、Na2CO3、HCl
C.Na2CO3、BaCl2、NaOH、HCl
D.NaOH、BaCl2、Na2CO3、HCl.
请回答下列问题:

【实验过程】
(1)称量与溶解
①调节托盘天平(如图甲):使游码回零,若天平指针偏向左边,可将左边螺母向右(填“左”或“右”)旋动,使指针摆动达到平衡.
②用托盘天平称取粗盐的质量为2g(只用到游码,平衡时游码位置如图乙):再用量筒称取10mL蒸馏水,将粗盐和蒸馏水转移到烧杯中,用玻璃棒搅拌,使粗盐充分溶解.
(2)过滤
③制作过滤器,并进行过滤操作,然后仔细观察过滤纸上的剩余物质及滤液的颜色.
④一开始时,乐乐小组同学的过滤操作(如图丙).
请将其中的错误之处加以指正:没有玻璃棒引流.
⑤老师发现红红同学过滤的速度明显比其它的小组要慢,分析其中可能的原因是:滤纸和漏斗壁之间有气泡.
(3)蒸发
将过滤后所得的溶液转移后进行蒸发(如图丁),待出现较多固体时,停止加热,利用余热将滤液蒸干.
⑥盛装滤液的仪器甲的名称是蒸发皿.
⑦玻璃棒所起的作用是使液体均匀受热,防止局部温度过高,造成液滴飞溅.
(4)计算产率
蒸发操作结束后,用玻璃棒将固体转移到纸片上,比较食盐提纯前后的状态,称量提纯后的食盐(精盐)的质量为1.7g.最后将固体回收到指定的容器中.
⑧精盐产率(%)的计算过程和结果=85%.
【拓展提升】
(5)物质溶解情况可以定量表示,现提供氯化钠和硝酸钾的溶解度数据如表所示.
| 温度/℃ | 0 | 10 | 20 | 30 | 40 | 50 | 60 | 70 | 80 | 90 | 100 | |
| 溶解度/g | NaCl | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 | 37.3 | 37.8 | 38.4 | 39.0 | 39.8 |
| KNO3 | 13.3 | 20.9 | 31.6 | 45.8 | 63.9 | 85.5 | 110 | 138 | 169 | 202 | 246 | |
⑩在化学上,分离物质有多种方法.欲使某温度下的硝酸钾饱和溶液中的硝酸钾析出,你认为可能的方法有冷却热饱和溶液(降温结晶),若从硝酸钾和氯化钠(少量)的混合物中分离出硝酸钾,你的实验方案是:先制成高温下的硝酸钾饱和溶液,再冷却,过滤.
(6)“粗盐的初步提纯”实验中得到的精盐并不是纯净物,还含有少量可溶性的杂质.若要除去其中含有的Mg2+、Ca2+、和硫酸根,依次加入下列试剂(每一步都过量)并采取相应的实验操作手段,能够达到实验目的是:BD.
A.BaCl2、NaOH、Na2CO3、H2SO4
B,BaCl2、NaOH、Na2CO3、HCl
C.Na2CO3、BaCl2、NaOH、HCl
D.NaOH、BaCl2、Na2CO3、HCl.
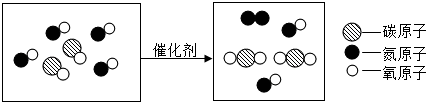
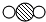 中“
中“ ”与“
”与“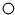 ”的质量比是3:8(填最简整数比).
”的质量比是3:8(填最简整数比).