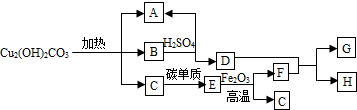
题目内容
碱式碳酸铜[Cu2(OH)2CO3]是一种用途广泛的化工原料,某研究小组在实验室里以废铜屑为原料制取碱式碳酸铜,若实验得到2.42g样品(只含CuO杂质),取此样品加热至分解完全后,得到1.80g固体,此样品中碱式碳酸铜的质量分数是多少?
设此样品中碱式碳酸铜的质量为x
Cu2(OH)2CO3
2CuO+H2O+CO2↑△m(减小量)
222 160 222-160=62
x (2.42g-1.8g)=0.62g
=
x=2.22g
此样品中碱式碳酸铜的质量分数是
×100%=91.7%
答:此样品中碱式碳酸铜的质量分数是91.7%;
Cu2(OH)2CO3
| ||
222 160 222-160=62
x (2.42g-1.8g)=0.62g
| 222 |
| x |
| 62 |
| 0.62g |
x=2.22g
此样品中碱式碳酸铜的质量分数是
| 2.22g |
| 2.42g |
答:此样品中碱式碳酸铜的质量分数是91.7%;

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目