题目内容
某化学兴趣小组欲测定某石灰石样品中碳酸钙的质量分数.取20g石灰石样品(假设杂质既不溶于水,也不与其他物质反应),向其中加入100g一定溶质质量分数的稀盐酸,恰好完全反应,称得固液混合物的质量为113.4g.请回答下列问题:
(1)生成二氧化碳的质量是多少?
(2)该样品中碳酸钙的质量分数是多少?
(3)向反应后的固液混合物中加入113.6g水,充分搅拌后过滤,得到只含一种溶质的不饱和溶液,则所得不饱和溶液中溶质的质量分数是多少?
(1)生成二氧化碳的质量是多少?
(2)该样品中碳酸钙的质量分数是多少?
(3)向反应后的固液混合物中加入113.6g水,充分搅拌后过滤,得到只含一种溶质的不饱和溶液,则所得不饱和溶液中溶质的质量分数是多少?
考点:根据化学反应方程式的计算,有关溶质质量分数的简单计算
专题:溶质质量分数与化学方程式相结合的计算
分析:(1)根据已知条件和质量守恒定律可知,反应后物质质量之和比反应前物质质量之和减少的质量就是生成气体的质量(因为气体逸出);
(2)根据碳酸钙与盐酸反应的化学方程式和二氧化碳的质量,即可得出碳酸钙质量,进而求得其质量分数;
(3)根据碳酸钙与盐酸反应的化学方程式和二氧化碳的质量,即可得出生成的氯化钙的质量,计算出不饱和溶液的质量后即可计算得出不饱和溶液中溶质的质量分数.
(2)根据碳酸钙与盐酸反应的化学方程式和二氧化碳的质量,即可得出碳酸钙质量,进而求得其质量分数;
(3)根据碳酸钙与盐酸反应的化学方程式和二氧化碳的质量,即可得出生成的氯化钙的质量,计算出不饱和溶液的质量后即可计算得出不饱和溶液中溶质的质量分数.
解答:解:(1)由题意可知,生成二氧化碳气体的质量=20g+100g-113.4g=6.6g;
(2)设该样品中参加反应的碳酸钙质量为x,反应生成氯化钙的质量为y
CaCO3+2HCl=CaCl2+H2O+CO2↑
100 111 44
x y 6.6g
=
;
=
;
解得:x=15g;y=16.65g;
该样品中碳酸钙的质量分数=
×100%=75%;
即石灰石样品中碳酸钙的质量分数75%
(3)向反应后的固液混合物中加入113.6g水,充分搅拌后过滤,
得到只含一种溶质氯化钙的不饱和溶液的质量为:
113.4g-(20g-15g)+113.6g=222g,
所得不饱和溶液中溶质的质量分数为:
×100%=7.5%
答案:
(1)生成二氧化碳的质量6.6g;
(2)石灰石样品中碳酸钙的质量分数75%;
(3)所得不饱和溶液中溶质的质量分数为7.5%.
(2)设该样品中参加反应的碳酸钙质量为x,反应生成氯化钙的质量为y
CaCO3+2HCl=CaCl2+H2O+CO2↑
100 111 44
x y 6.6g
| 100 |
| 44 |
| x |
| 6.6g |
| 111 |
| 44 |
| y |
| 6.6g |
解得:x=15g;y=16.65g;
该样品中碳酸钙的质量分数=
| 15g |
| 20g |
即石灰石样品中碳酸钙的质量分数75%
(3)向反应后的固液混合物中加入113.6g水,充分搅拌后过滤,
得到只含一种溶质氯化钙的不饱和溶液的质量为:
113.4g-(20g-15g)+113.6g=222g,
所得不饱和溶液中溶质的质量分数为:
| 16.65g |
| 222g |
答案:
(1)生成二氧化碳的质量6.6g;
(2)石灰石样品中碳酸钙的质量分数75%;
(3)所得不饱和溶液中溶质的质量分数为7.5%.
点评:本题主要考查学生利用化学方程式和溶质质量分数公式进行计算的能力.

练习册系列答案
相关题目
下列有关“含量”的说法正确的是( )
| A、人体中含量最多的是水元素 | ||
| B、地壳中含量最多的金属元素是Al | ||
C、空气中氧气含量约占其质量的
| ||
| D、全球水储量中含量最多的是淡水 |
图示实验所得出的结论中,不正确的是( )
A、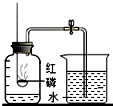 氧气约占空气体积的
| ||
B、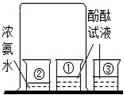 证明分子是不断运动的 | ||
C、 天平不平衡说明该反应不遵守质量守恒定律 | ||
D、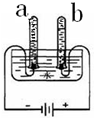 氢气与氧气的体积比为2:1 |
属于浊液的是( )
| A、香水 | B、“雪碧”汽水 |
| C、碘酒 | D、牛奶 |


