题目内容
6.高纯硅是信息产业的核心材料,没有硅就没有你喜欢的计算机,请你用学过的知识回答下列问题:(1)地壳中含有大量的硅元素,它的含量仅次于氧元素.(用元素符号表示)
(2)SiO2是沙的主要成分,工业上制取粗硅的化学方程式为:SiO2+2C=Si+2R,R的化学式为CO,该化学反应的基本类型是下列中③.
①化合反应 ②分解反应 ③置换反应 ④复分解反应
(3)实验室盛放氢氧化钠溶液的试剂瓶不能用玻璃塞,其原因是在常温下,氢氧化钠与玻璃中的二氧化硅缓慢的发生反应,产物使瓶口与瓶塞粘合在一起.反应化学方程式为:SiO2+2NaOH=Na2SiO3+H2O.所以我们用到是橡胶塞,如果氢氧化钠溶液暴露在空气中很容易变质.请写出氢氧化钠在空气中变质的化学方程式:SiO2+2NaOH=Na2SiO3+H2O.
分析 (1)(2)根据地壳里各元素的含量由多到少的顺序排列依次是氧,硅,铝,铁,和元素质量守恒定律及置换反应的概念进行分析解答本题;
(3)根据题中信息结合化学方程式的书写方法进行分析即可.
解答 解:(1)根据地壳里各元素的含量由多到少的顺序排列依次是氧,硅,铝,铁,可知:
地壳中含有大量的硅元素,它的含量仅次于氧元素,故答案为:氧;
(2)根据元素质量守恒定律可知:化学方程式 SiO2+2C$\frac{\underline{\;高温\;}}{\;}$Si+2R 中 可推测 R 的化学式为 CO;
根据置换反应是单质与化合物反应生成另外的单质和化合物的化学反应,可知该反应属于置换反应;
故选CO;③;
(3)氢氧化钠与二氧化硅反应生成了硅酸钠和水,反应的方程式是:SiO2+2NaOH=Na2SiO3+H2O.
故答案为:SiO2+2NaOH=Na2SiO3+H2O
点评 本题考查学生根据地壳里各元素的含量,和元素质量守恒定律及置换反应的概念进行分析解题的能力

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
17.使用托盘天平.若指针偏右就进行称量,则称量结果与实际质量相比( )
| A. | 偏大 | B. | 偏小 | C. | 相等 | D. | 无法确定 |
14.石灰厂为了测定一批石灰石样品中碳酸钙的质量分数,取用4g石灰石样品,把20g稀盐酸分4次加入样品中(样品中除碳酸钙外,其余的成分既不与盐酸反应,也不溶于水),充分反应后经过滤、干燥等操作,最后称量,得实验数据如下表:
(1)该石灰石样品中碳酸钙的质量分数是75%;
(2)煅烧这种石灰石样品100t,最多能制得生石灰多少?
(3)计算该稀盐酸的溶质质量分数(指这20g的稀盐酸中HCl所占的百分含量)
(后二小题应写出计算过程,结果精确到0.1%).
| 稀盐酸的用量 | 第一次加入5g | 第二次加入5g | 第三次加入5g | 第四次加入5g |
| 剩余固体的质量 | 3g | 2g | l g | 1g |
(2)煅烧这种石灰石样品100t,最多能制得生石灰多少?
(3)计算该稀盐酸的溶质质量分数(指这20g的稀盐酸中HCl所占的百分含量)
(后二小题应写出计算过程,结果精确到0.1%).
18. 探究实验展示了化学的无穷魅力.我们在实验的过程中也提炼了许多探究方法.
探究实验展示了化学的无穷魅力.我们在实验的过程中也提炼了许多探究方法.
【提出问题】小松想探究分子的运动速率与相对分子质量的关系.
【假设猜想】①分子质量(相对分子质量)越大,分子运动速率越快;②分子质量(相对分子质量)越小,分子运动速率越快.
【查阅资料】已知浓氨水能挥发出氨气,浓盐酸能挥发出氯化氢气体,二者接触反应会产生白烟(即氯化铵固体).
【设计实验】如图所示,在玻璃管两端分别放入蘸有浓氨水和浓盐酸的棉花团.
【实验现象】C处产生的白烟较多.
【解释与结论】(1)氨分子的相对分子质量小于(填“大于”、“等于”或“小于”)氯化氢分子的相对分子质量,由此可知,相对分子质量越大,分子运动的速率越慢(填“快”或“慢”).
(2)反应的化学方程式为NH3+HCl═NH4Cl,34g 氨与足量氯化氢反应,生成的氯化铵的质量为107g.
【拓展探究】小松在完成上述实验后,还想研究分子运动速率与温度的关系.
他将等量的品红(一种红色颜料)分别滴入到等量的热水和冷水中,其实验现象如下所示.
(3)依据此实验现象,得出的结论是温度越高,分子的运动越快.
 探究实验展示了化学的无穷魅力.我们在实验的过程中也提炼了许多探究方法.
探究实验展示了化学的无穷魅力.我们在实验的过程中也提炼了许多探究方法.【提出问题】小松想探究分子的运动速率与相对分子质量的关系.
【假设猜想】①分子质量(相对分子质量)越大,分子运动速率越快;②分子质量(相对分子质量)越小,分子运动速率越快.
【查阅资料】已知浓氨水能挥发出氨气,浓盐酸能挥发出氯化氢气体,二者接触反应会产生白烟(即氯化铵固体).
【设计实验】如图所示,在玻璃管两端分别放入蘸有浓氨水和浓盐酸的棉花团.
【实验现象】C处产生的白烟较多.
【解释与结论】(1)氨分子的相对分子质量小于(填“大于”、“等于”或“小于”)氯化氢分子的相对分子质量,由此可知,相对分子质量越大,分子运动的速率越慢(填“快”或“慢”).
(2)反应的化学方程式为NH3+HCl═NH4Cl,34g 氨与足量氯化氢反应,生成的氯化铵的质量为107g.
【拓展探究】小松在完成上述实验后,还想研究分子运动速率与温度的关系.
他将等量的品红(一种红色颜料)分别滴入到等量的热水和冷水中,其实验现象如下所示.
| 实验过程 | 冷水 | 热水 |
| 开始 | 红色扩散较慢 | 红色扩散较快 |
| 长久放置 | 最终均成为红色、均匀、透明的液体 | |
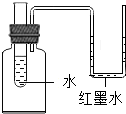 如图所示的装置中,加入氢氧化钠固体,片刻后U型管中左侧液面将下降(填上升、下降或不变),产生这一现象的原因是向水中加入的氢氧化钠溶于水时放热,使瓶内气体压强增大.若用代替氢氧化钠固体,U型管中液面会出现相反的现象.
如图所示的装置中,加入氢氧化钠固体,片刻后U型管中左侧液面将下降(填上升、下降或不变),产生这一现象的原因是向水中加入的氢氧化钠溶于水时放热,使瓶内气体压强增大.若用代替氢氧化钠固体,U型管中液面会出现相反的现象. 课外活动小组设计了测定空气中氧气含量的实验,实验装置如图所示:
课外活动小组设计了测定空气中氧气含量的实验,实验装置如图所示: