题目内容
一般情况下,金属越活泼,与酸反应的速度越快.为了探究金属
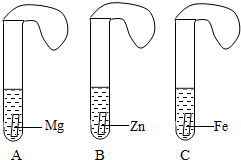
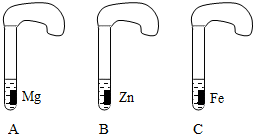
Mg、Zn、Fe与酸反应的快慢,某研究性学习小组设计了如下的实验.[
实验步骤]①取A、B、C三支试管,分别加入2mL浓度相同的盐酸溶液;②分别加入足量的大、小相等的Mg、Zn、Fe块,应立即把三个相同的气球分别套在各试管口上.[
实验预测与分析](1)
写出铁与盐酸反应的化学方程式_______________;(2)
气球膨胀速度最快的是__________________;(3)
该实验表明,实验室一般选用锌而不选用镁、铁制取氢气的主要原因是________________________;(4)
步骤②是实验获得成功的关键,你认为在操作过程中小组成员之间应该________________________.
答案:略
解析:
解析:
|
(1) (2)Mg (3) 锌反应速度适中,容易控制(或镁反应速度太快,而铁反应速度太慢)(4) 分工合作,团结协作等(合理即可)(1) 铁与盐酸反应生成+2价铁的化合物.(2)由已知条件金属越活泼与酸反应越快可知Mg在三种金属中最活泼;Mg与酸反应气球膨胀最快.(3)应从金属与酸反应快慢对比分析.(4)三个反应同时进行需实验小组的同学团结协作各负其责,体现了合作探究的学习方法. |

练习册系列答案
相关题目


 19、一般情况下,金属越活泼,与酸反应的速度越快.为了探究金属Mg、Zn、Fe与酸反应的快慢,某研究性学习小组设计了如下的实验,实验步骤:
19、一般情况下,金属越活泼,与酸反应的速度越快.为了探究金属Mg、Zn、Fe与酸反应的快慢,某研究性学习小组设计了如下的实验,实验步骤: