题目内容
(3分)烧杯中盛有20.4g Na2CO3和NaCl 组成的固体混合物,向其中逐渐滴加溶质质量分数为10%的稀盐酸。放出气体的质量与所加入稀盐酸的质量关系曲线如图所示,请根据题意回答问题:
(1)当滴加稀盐酸至图中B点时,烧杯中溶液的的溶质是 (写化学式)。
(2)当滴加稀盐酸至图中A点时,烧杯中为不饱和溶液(常温),通过计算求出其中溶质的质量分数。

35.(3分)
(1)NaCl和HCl…………………………………1分
(2)解:设固体混合物中Na2CO3的质量为x;Na2CO3和稀盐酸反应生成NaCl的质量为y,生成CO2的质量为z
当滴加稀盐酸至A点时,消耗HCl的质量=73g×10%=7.3g
Na2CO3+2HCl 2NaCl+H2O+CO2↑
106 73 117 44
x 7.3g y z
 =
= 或
或 =
=
x= =10.6g……………………………………1分
=10.6g……………………………………1分
y=11.7g z=4.4g
则固体混合物中NaCl的质量=20.4g-10.6g=9.8g
A点时溶液中溶质NaCl的总质量=9.8g+11.7g=21.5g
A点时溶液中溶质NaCl的质量分数为: ×100%=24.2%
×100%=24.2%
答: A点时溶液中溶质的质量分数为24.2%。
【解析】
试题分析:(1)Na2CO3和NaCl 组成的固体混合物中,只有碳酸钠与盐酸反应,生成氯化钠和二氧化碳与水,当滴加稀盐酸至图中B点时,盐酸已经过量,故此时溶液中溶质为NaCl和HCl;
(2)当滴加稀盐酸至图中A点时,碳酸钠与盐酸恰好反应,则:
解:设固体混合物中Na2CO3的质量为x;Na2CO3和稀盐酸反应生成NaCl的质量为y,生成CO2的质量为z
当滴加稀盐酸至A点时,消耗HCl的质量=73g×10%=7.3g
Na2CO3+2HCl 2NaCl+H2O+CO2↑
106 73 117 44
x 7.3g y z
 =
= 或
或 =
=
x= =10.6g
=10.6g
y=11.7g z=4.4g
则固体混合物中NaCl的质量=20.4g-10.6g=9.8g
A点时溶液中溶质NaCl的总质量=9.8g+11.7g=21.5g
A点时溶液中溶质NaCl的质量分数为: ×100%=24.2%
×100%=24.2%
答: A点时溶液中溶质的质量分数为24.2%。
考点:反应中的数量关系图;根据化学方程式计算。
点评:读懂图是解题的关键,根据化学方程式计算,要注意解题步骤,设、写、找、列、解、答。

 阅读快车系列答案
阅读快车系列答案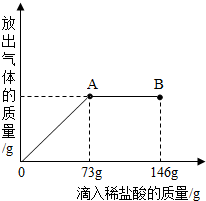 已知Na2CO3的水溶液呈碱性,在一烧杯中盛有20.4g Na2CO3和NaCl组成的固体混合物.向其中逐渐滴加溶质质量分数为10%的稀盐酸.放出气体的总质量与所滴入稀盐酸的质量关系曲线如下图所示,请根据题意回答问题:
已知Na2CO3的水溶液呈碱性,在一烧杯中盛有20.4g Na2CO3和NaCl组成的固体混合物.向其中逐渐滴加溶质质量分数为10%的稀盐酸.放出气体的总质量与所滴入稀盐酸的质量关系曲线如下图所示,请根据题意回答问题: 在一烧杯中盛有20.4g Na2CO3和NaCl 组成的固体混合物.向其中逐渐滴加溶质质量分数为10%的稀盐酸.放出气体的总质量与所滴入稀盐酸的质量关系曲线如图所示,请根据题意回答问题:
在一烧杯中盛有20.4g Na2CO3和NaCl 组成的固体混合物.向其中逐渐滴加溶质质量分数为10%的稀盐酸.放出气体的总质量与所滴入稀盐酸的质量关系曲线如图所示,请根据题意回答问题: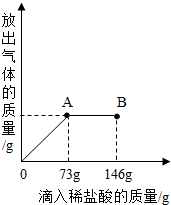 已知 Na2CO3的水溶液呈碱性,在一烧杯中盛有20.4g Na2CO3和NaCl 组成的固体混合物.向其中逐渐滴加溶质质分数为10%的稀盐酸.放出气体的总质量与所滴入稀盐酸的质量关系曲线如图所示,请根据题意回答问题:
已知 Na2CO3的水溶液呈碱性,在一烧杯中盛有20.4g Na2CO3和NaCl 组成的固体混合物.向其中逐渐滴加溶质质分数为10%的稀盐酸.放出气体的总质量与所滴入稀盐酸的质量关系曲线如图所示,请根据题意回答问题: (2013?临邑县二模)已知Na2CO3的水溶液呈碱性,在一烧杯中盛有20.4g Na2CO3和NaCl组成的固体混合物.向其中逐渐滴加溶质质分数为10%的稀盐酸.放出气体的总质量与所滴入稀盐酸的质量关系曲线如图所示,请根据题意回答问题:
(2013?临邑县二模)已知Na2CO3的水溶液呈碱性,在一烧杯中盛有20.4g Na2CO3和NaCl组成的固体混合物.向其中逐渐滴加溶质质分数为10%的稀盐酸.放出气体的总质量与所滴入稀盐酸的质量关系曲线如图所示,请根据题意回答问题: