题目内容
14.下列事实不能用质量守恒定律解释的是( )| A. | 蜡烛在空气中燃烧后,质量减小 | |
| B. | 铜粉在空气中及加热后,质量增大 | |
| C. | 水结冰后,质量保持不变 | |
| D. | 1.2g碳与3.2g氧气完全反应,生成4.4g二氧化碳 |
分析 化学变化和物理变化的本质区别是否有新物质生成.化学反应都遵循质量守恒定律,一般物理变化不能用质量守恒定律解释.
解答 解:A.蜡烛燃烧生成二氧化碳和水,散失到周围的空气中去了,故质量明显减轻,属于化学变化,可以用质量守恒定律解释;
B.铜粉放置在空气中一段时间后质量增加了,是因为铜与氧气发生了化学反应,可以用质量守恒定律解释;
C.水结冰,属于物理变化,不能用质量守恒定律解释物理变化,不能用质量守恒定律解释;
D.碳与氧气在点燃的条件下反应生成二氧化碳的化学方程式为C+O2$\frac{\underline{\;点燃\;}}{\;}$CO2;
12 32 44
由三种物质间的质量关系可知,1.2g碳与3.2g氧气完全反应,生成4.4g二氧化碳,这符合质量守恒定律,可以用质量守恒定律解释.
故选C.
点评 知道质量守恒定律只适合于化学变化,在化学反应中,参加反应前各物质的质量总和等于反应后生成各物质的质量总和;掌握化学变化和物理变化的判别是解题的关键.

练习册系列答案
 核心素养学练评系列答案
核心素养学练评系列答案 单元期中期末卷系列答案
单元期中期末卷系列答案
相关题目
4.属于同素异形体的是( )
| A. | 一氧化碳和二氧化碳 | B. | 水和双氧水 | ||
| C. | 碳60和石墨 | D. | 氧气和液氧 |
2.密闭容器内有两种物质,在一定条件下充分反应,测得反应前后各物质的质量如表,下列说法正确的是
( )
( )
| 物质 | X | Y | Z | Q |
| 反应前质量/g | 8 | 2 | 20 | 5 |
| 反应后质量/g | 待测 | 12 | 8 | 15 |
| A. | 反应后X的质量为16g | B. | 该反应的反应物是X、Y | ||
| C. | 参加反应的X、Z的质量比是2:3 | D. | Y、Q的相对分子质量比一定为1:1 |
9.下列物质的用途利用了其物理性质的是( )
| A. | 生活中用镶有金刚石的玻璃刀裁划玻璃 | |
| B. | 煤作燃料 | |
| C. | 工业上常用一氧化碳作还原剂冶炼金属 | |
| D. | 化工生产中以煤为原料制取甲醇 |
19.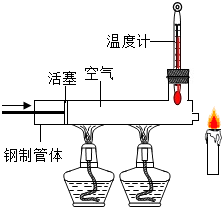 已知石蜡的着火点约为190℃,蜡烛的火焰由气态蜡燃烧形成,如图所示,在温度计示数为280℃以上时,快速推动活塞,观察到蜡烛立即熄灭,蜡烛熄灭的主要原因是( )
已知石蜡的着火点约为190℃,蜡烛的火焰由气态蜡燃烧形成,如图所示,在温度计示数为280℃以上时,快速推动活塞,观察到蜡烛立即熄灭,蜡烛熄灭的主要原因是( )
 已知石蜡的着火点约为190℃,蜡烛的火焰由气态蜡燃烧形成,如图所示,在温度计示数为280℃以上时,快速推动活塞,观察到蜡烛立即熄灭,蜡烛熄灭的主要原因是( )
已知石蜡的着火点约为190℃,蜡烛的火焰由气态蜡燃烧形成,如图所示,在温度计示数为280℃以上时,快速推动活塞,观察到蜡烛立即熄灭,蜡烛熄灭的主要原因是( )| A. | 隔绝氧气 | B. | 气流带走可燃物 | ||
| C. | 降低温度至着火点以下 | D. | 无法判断 |
6.根据如图所示实验装置,回答问题.
(1)写出图中仪器a的名称:长颈漏斗.
(2)实验室用加热氯酸钾和二氧化锰混合物制取氧气的化学方程式为2KClO3$\frac{\underline{\;MnO_{2}\;}}{△}$2KCl+3O2↑,可选择的收集装置为C或D(填字母).
(3)实验室用石灰石和稀盐酸反应制取二氧化碳,可选择的发生装置是CaCO3+2HCl═CaCl2+H2O+CO2↑,该反应生成的二氧化碳气体中常混有少量氯化氢气体,可通过盛有饱和碳酸氢钠溶液的F装置除去氯化氢气体,则该混合气体应从F装置的②口(填“①”或“②”)通入.
| 发生装置 | 收集装置 | 洗气装置 |
 |  |  |
(2)实验室用加热氯酸钾和二氧化锰混合物制取氧气的化学方程式为2KClO3$\frac{\underline{\;MnO_{2}\;}}{△}$2KCl+3O2↑,可选择的收集装置为C或D(填字母).
(3)实验室用石灰石和稀盐酸反应制取二氧化碳,可选择的发生装置是CaCO3+2HCl═CaCl2+H2O+CO2↑,该反应生成的二氧化碳气体中常混有少量氯化氢气体,可通过盛有饱和碳酸氢钠溶液的F装置除去氯化氢气体,则该混合气体应从F装置的②口(填“①”或“②”)通入.
4.下列关于溶液的说法正确的是( )
| A. | 溶液是无色透明的 | B. | 均一稳定的液体就是溶液 | ||
| C. | 澄清石灰水的溶质是氧化钙 | D. | 碘酒中的溶剂是酒精 |
 黄铜(铜锌合金)是重要的金属材料,常用来制造机械零件、仪表和日用品.为测定某黄铜材料中锌的含量,化学研究小组进行了实验:称取15.0g此黄铜材料,向其中逐渐如入稀盐酸,测定产生气体的质量和加入稀盐酸的质量,并根据实验情况绘制了产生气体质量与加入稀盐酸质量的关系图.请你仔细分析此关系图,并进行计算:l5.0g黄铜材料中锌的质量分数是多少?(计算结果精确到0.1%).
黄铜(铜锌合金)是重要的金属材料,常用来制造机械零件、仪表和日用品.为测定某黄铜材料中锌的含量,化学研究小组进行了实验:称取15.0g此黄铜材料,向其中逐渐如入稀盐酸,测定产生气体的质量和加入稀盐酸的质量,并根据实验情况绘制了产生气体质量与加入稀盐酸质量的关系图.请你仔细分析此关系图,并进行计算:l5.0g黄铜材料中锌的质量分数是多少?(计算结果精确到0.1%).