题目内容
【题目】小明和同学用稀盐酸与锌制取氢气时,发现添加少量硫酸铜溶液能加快反应。硫酸铜溶液是稀盐酸和锌反应的催化剂吗?

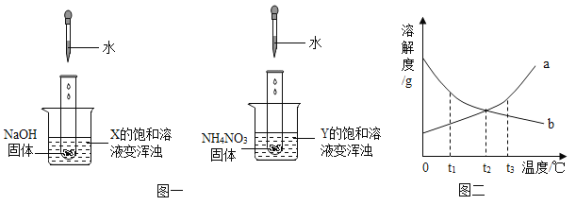
(1)他们先进行如图实验,观察到试管乙中产生气泡速度快得多,并有红色固体生成。试管甲中发生反应的方程式___甲实验的作用是___,他们认为CuSO4溶液不是催化剂,所依据的实验现象是____。
(探究2)反应速率加快的原因是什么?小组同学提出了以下猜想。
猜想一:起促进作用的是硫酸根离子
猜想二:起促进作用的是铜离子
猜想三:生成物质起到促进作用
(2)小明将硫酸铜溶液换成硫酸钠溶液、发现反应速率几乎没有变化,则猜想_____不正确。小明取适量锌加入一定量稀盐酸,然后加入少量硫酸铜溶液,观察到红色固体生成,溶液变为无色后,产生气泡速率加快依然较明显,小明得出猜想____正确。
(探究3)硫酸铜溶液量的多少会影响反应速率吗?
(实验)在6支试管中分别加入2颗大小形状都相同的锌粒,倒入等质量、等质量分数的稀盐酸;按下表所示条件进行实验,并测量收集50毫升氢气所用的时间。记录如下:
试管 | A | B | C | D | E | F |
CuSO4溶液/毫升 | 0 | 0.5 | 1 | 1.5 | 2 | 4 |
水/毫升 | 4 | 3.5 | 3 | V1 | V2 | 0 |
收集H2所用的时间/秒 | 348 | 246 | 190 | 165 | 230 | 360 |
①为了使稀盐酸的溶质质量分数相同,试管D中加入水的体积V1=______毫升;
②由上表可得出,CuSO4的溶液的量对稀硫酸与锌反应速率影响的变化趋势是___。
③小王觉得用稀硫酸比用稀盐酸制取的氢气更纯净,原因是______。
【答案】Zn+2HCl= ZnCl2+H2↑ 对照实验 有红色固体生成 一 三 2.5 先加快后减慢 盐酸具有挥发性,收集的氢气中可能有氯化氢气体
【解析】
(1)甲中的反应为锌与稀盐酸反应,方程式为Zn+2HCl= ZnCl2+H2↑,其作用为对照实验,对照乙加入硫酸铜溶液的反应现象;因为有红色固体生成,不符合催化剂反应前后化学性质不变的特点;
(2)把硫酸铜换成硫酸钠得到速率没变,说明硫酸根离子不能改变反应速率,猜想一错误;溶液变无色后速率依然较快,说明铜离子也不能加快反应速率,应是生成物影响,即猜想三正确;
(3)可观察到,控制水与硫酸铜的总体积为4ml,当有1.5ml硫酸铜溶液时,水的体积应为2.5ml;根据表格可看到,随CuSO4溶液的增多,产生氢气的速率由慢至快又变慢,所以CuSO4溶液的增多,产生氢气的速率先加快后减慢;因为盐酸具有挥发性,收集的氢气中可能有氯化氢气体,而硫酸没有挥发性,故用稀硫酸比用稀盐酸制取的氢气更纯净。

【题目】如表中,有关量的变化图象与其对应叙述不相符的是( )
|
|
|
|
向饱和大水中加入少量的生石灰 | 向一定质量含CaCl2和HCl的混合溶液中逐滴加入Na2CO3溶液 | 向水中加入少量稀硫酸,通电一段时间 | 用等质量、等浓度的双氧水分别抽取氧气 |
A | B | C | D |
A.AB.BC.CD.D