题目内容
15.元素周期表是学习和研究化学的重要工具.请根据如表(元素周期表的部分内容)回答有关问题:
(1)请从上表中查出关于硅元素的一条信息:硅的元素符号为Si或硅原子的核电荷数为14或硅原子的相对原子质量为28.09.
(2)第3周期中属于金属元素的是Na(填一种),其离子符号为Na+.
(3)第11号元素与第17号元素组成的化合物的化学式是NaCl,构成该物质的微粒是离子(填“分子”、“原子”或“离子”).
(4)第9号氟元素和氢元素形成的化合物的水溶液氢氟酸(HF)可用于玻璃雕刻,其主要原理是氢氟酸与玻璃的主要成分二氧化硅(SiO2)发生反应,生成四氟化硅气体(SiF4)和水,该反应的化学方程式为4HF+SiO2=SiF4↑+2H2O.
分析 (1)根据元素周期表中每一小方格中的信息分析;
(2)根据元素周期表的内容以及离子符号的书写方法来分析;
(3)依据最外层电子数的特点判断该元素的化合价数值,据此可写相关的化学式;
(4)首先根据反应原理找出反应物、生成物、反应条件,根据化学方程式的书写方法、步骤进行书写即可.
解答 解:(1)元素周期表中每一小方格中左上角数字表示原子序数即核电荷数,符号表示元素符号,下方数字表示相对原子质量,因此关于硅元素的一条信息为硅的元素符号为Si,或:硅原子的核电荷数为14或硅原子的相对原子质量为28.09.故填:硅的元素符号为Si或硅原子的核电荷数为14或硅原子的相对原子质量为28.09;
(2)第三周期中的金属元素是钠、镁、铝三种元素,在化学反应中均易失去最外层的电子,而形成阳离子,故填:Na,Na+(或Mg,Mg2+或Al,Al3+);
(3)11号钠元素最外层电子数为1,故化合价+1价;17号元素为氯,故化合价为-1价,故钠元素和氯元素组成的化合物的化学式为NaCl,构成该物质的微粒是钠离子和氯离子;故填:NaCl;离子;
(4)氢氟酸与玻璃的主要成分二氧化硅发生反应,生成四氟化硅气体和水,反应的化学方程式为:4HF+SiO2=SiF4↑+2H2O.
故填:4HF+SiO2=SiF4↑+2H2O.
点评 本题难度较小,考查学生灵活应用元素周期表的相关知识解答有关问题的能力.

练习册系列答案
 冲刺100分1号卷系列答案
冲刺100分1号卷系列答案
相关题目
18.下列物质中属于纯净物的是( )
| A. | 碘酒 | B. | 黄铜 | C. | 氧气 | D. | 石油 |
3.甲和乙在一定条件下恰好完全反应生成丙和丁.结合微观示意图分析,下列结论正确的是( )


| A. | 甲的化学式为H2O | |
| B. | 反应中甲、乙、丁的分子个数比为1:2:1 | |
| C. | 若32g乙参加反应,则生成18g丁 | |
| D. | 丁中氧元素的质量一定等于参加反应的乙的质量 |
10.下列现象或事实,用分子的相关知识解释不正确的是( )
| A. | 水沸腾时可掀起壶盖,说明分子大小随温度升高而增大 | |
| B. | 1滴水中大约有1.67×1021个水分子,说明分子很小 | |
| C. | 湿衣服晾在太阳下干得快,说明分子运动速率与温度有关 | |
| D. | 600L氧气加压后可储存在4L钢瓶中,说明气体分子之间间隔较大 |
20.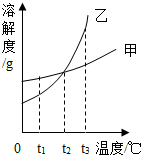 如图甲、乙两物质的溶解度曲线,下列说法中正确的是( )
如图甲、乙两物质的溶解度曲线,下列说法中正确的是( )
 如图甲、乙两物质的溶解度曲线,下列说法中正确的是( )
如图甲、乙两物质的溶解度曲线,下列说法中正确的是( )| A. | 若将t1℃时的甲、乙的饱和溶液升温至t2℃时,甲、乙溶液中溶质的质量分数相等 | |
| B. | 若将t3℃时的甲、乙的饱和溶液降温至t2℃时,甲、乙两溶液中均有晶体析出 | |
| C. | t2℃时,甲、乙的饱和溶液和溶液中含有的溶质质量甲大于乙 | |
| D. | 当甲中混有少量乙时,可采用冷却热饱和溶液的方法提纯 |
 现有一瓶葡萄糖溶液,部分标签如图所示,请计算:
现有一瓶葡萄糖溶液,部分标签如图所示,请计算: