题目内容
用海水制得的粗盐中含有多种可溶性杂质(氯化镁、氯化钙等)和不溶性杂质(泥沙等)。请回答下列问题:
(1)实验室去除粗盐中难溶性杂质的一般步骤是:溶解、过滤、 、计算产率;
(2)若要去除粗盐中可溶性的杂质氯化镁和氯化钙,可以依次加入过量的氢氧化钠和碳酸钠两种溶液,写出其中的一个化学方程式 ,过滤后向滤液中加入过量的盐酸,其目的是 ,最后通过蒸发结晶得到较为纯净的氯化钠。
(1)蒸发;(2) MgCl2+2NaOH=Mg(OH)2↓+2NaCl(或Na2CO3+ CaCl2 =CaCO3↓+2NaCl) 除去多余的氢氧化钠和碳酸钠
【解析】粗盐中难溶性杂质的除去,主要用过滤的方法除去,可将粗盐先溶于水,过滤除去杂质后再通过蒸发得到食盐晶体;氯化镁和氯化钙来说,真正的杂质应该是镁离子和钙离子,可分别通过与氢氧根离子和碳酸根离子结合生成沉淀而除去,为除尽杂质,所加试剂必须过量,所以最后加入盐酸,将多余的氢氧化钠和碳酸钠除去。

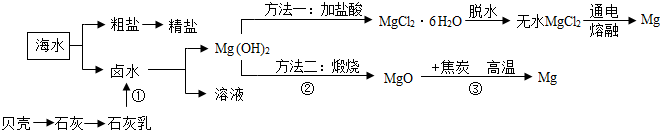
浩瀚的海洋不仅繁衍着无数水生生物,还蕴藏着丰富的化学资源,如氯化钠、氯化钙、氯化镁、溴化镁等大量的无机盐。
(1)(4分)请设计两种方法鉴别海水和蒸馏水的方法(只需说明原理)
方法一:
方法二:
(2)(3分)海水“晒盐”得到的粗盐中含有少量的泥沙等不溶性杂质,可采取以下步骤除去。请在括号内填上相应的操作步骤。( )→ ( )→ 蒸发结晶。
在实验室中完成粗盐的提纯实验,老师提供了烧杯、药匙、玻璃棒、铁架台、酒精灯、坩埚钳、蒸发皿、胶头滴管和滤纸等几种可供选择的实验仪器,要完成该实验还需要下列仪器中的 (填写一种仪器的代号)
A.集气瓶 B.漏斗 C.燃烧匙 D.试管夹
(3)(4分)通过以上步骤处理后,往往还含氯化镁、氯化钙等可溶性杂质,现对其进行提纯,主要操作流程如下:
 |
操作②的名称是 ,A是 ,B是 ,C是 。(选择合适序号填空)
A. Na2CO3 B. K2CO3 C. H2SO4 D. HCl E. NaOH
(4)(2分)海水淡化是国际上研究的热点问题,我国科学家在利用高分子膜进行海水淡化的研究上取得了一些成绩。高分子膜在海水淡化过程中的作用
。
(5)(8分)利用食盐可制得纯碱,我国科学家侯德榜创造了著名的纯碱生产方法“联合制碱法”。
①“联合制碱法”制得纯碱的过程,用化学方程式可简要表示为:
②该过程中,为什么氨盐水比食盐水更容易吸收二氧化碳
③ 氨盐水吸收二氧化碳后,生成物中为什么碳酸氢钠比氯化铵晶体先析出(参考右图)